作者:孙晓磊,潘俊兵,邓万冰,张铖,刘润禹,李杨欣,谢林灼,林倩,陈厚洁,刘勇
文章来源:中华普通外科杂志, 2023,38(6)
摘要
目的
探讨不同肠系膜上动脉缺血性疾病(superior mesenteric artery ischemic disease,SMAID)的临床特点,分析可能增加全因死亡率的危险因素。
方法
回顾性分析1999至2021年在西南医科大学附属医院确诊为SMAID的141例住院患者的临床资料。
结果
141例患者中男99例,女42例。患者年龄(63.75±13.16)岁;127例有腹痛症状;围手术期全因死亡27例。ROC曲线分析得到具有预测价值的年龄的最佳界值为64.5岁,多因素COX回归分析显示年龄≥65岁(HR=3.855,95% CI:1.739~8.545)、中性粒细胞数(HR=1.072,95% CI:1.018~1.130)、心功能衰竭(HR=2.863,95% CI:1.332~6.154)、肌酐(HR=1.009,95% CI:1.003~1.015)、D-二聚体(HR=1.112,95% CI:1.025~1.205)是SMAID全因死亡的独立危险因素。肠系膜上动脉夹层(superior mesenteric arterial disp,SMAD)的患者长期生存率明显高于其他的SAMID患者。肠系膜上动脉栓塞(superior mesenteric arterial embolism,SMAE)组与肠系膜上动脉血栓形成(superior mesenteric arterial thrombosis,SMAT)组的中性粒细胞数、中性粒细胞比例、D二聚体明显高于SMAD组与肠系膜上动脉粥样硬化性狭窄(atherosclerotic stenosis of superior mesenteric artery,ASSMA)组。
结论
SMAID好发于老年男性,以腹痛为主要症状,常合并有高血压等并发症,具有老龄、中性粒细胞数高、D-二聚体高等危险因素;SMAE组、SMAT组的中性粒细胞数、中性粒细胞比例、D二聚体明显高于SMAD组与ASSMA组,可作为鉴别的参考指标。
肠系膜上动脉缺血性疾病(superior mesenteric artery ischemic disease,SMAID)是一种非常严重的危及生命的疾病,死亡率很高,其病因有肠系膜上动脉夹层(superior mesenteric arterial disp,SMAD)、肠系膜上动脉栓塞(superior mesenteric arterial embolism,SMAE)、肠系膜上动脉粥样硬化性狭窄(atherosclerotic stenosis of superior mesenteric artery,ASSMA)、肠系膜上动脉血栓形成(superior mesenteric arterial thrombosis,SMAT)等[1]。早期诊断和及时治疗对于改善SMAID的预后至关重要[2]。本研究回顾性分析1999至2021年在西南医科大学附属医院血管外科确诊为SMAID的141例住院患者的临床资料,总结不同SMAID的临床特征,探究影响SMAID预后的危险因素。
资料与方法
一、研究对象
141例患者包括SMAD 58例,SMAE 36例,ASSMA 25例,SMAT 22例。纳入标准:经计算机断层造影(computed tomography angiography,CTA)、数字减影血管造影术(digital subtraction angiography,DSA)或开放手术诊断为SMAID的患者。排除标准:非血管外科住院的SMAID;主动脉夹层累及肠系膜上动脉的夹层、外伤导致的SMAD;病例资料严重缺失。

二、研究方法
从电子病历及纸质病历中检索SMAID患者,详细记录患者的基本信息如年龄、性别、住院时间、临床表现(腹痛、腰背痛、恶心或呕吐、腹泻、便血和腹膜炎体征)、既往病史或危险因素[高血压、糖尿病、冠心病、风心病、房颤、心功能衰竭、慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)、脑梗死、肝炎、肾功能不全、吸烟和饮酒史]。实验室检验结果包括:血细胞分析;ALT、AST、总蛋白(TP)、白蛋白,总胆固醇、甘油三酯、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL);凝血酶原时间(PT)、活化部分凝血酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(Fib)、凝血酶原时间-国际标准化比值(PT-INR)、D-二聚体。记录所有患者的治疗方案,包括初步治疗选择、后续治疗、抗血小板或抗凝药物的使用,手术相关的信息。记录并分析随访结果,包括随访时间、死亡及死亡原因、是否复发腹痛、失访人数。按SMAID病因将患者分为四组进行临床分析,对于病情存在交叉的患者,根据其来就诊的主要症状进行分类,如肠系膜上动脉粥样硬化继发血栓形成,归类为SMAT组。
三、治疗方法
患者入院后,根据患者具体病情及有无急诊手术指征,决定是否急诊手术。如无需急诊手术,则保守治疗。确诊SMAID后,常规给予液体复苏以增加内脏灌注,给予抗凝、解除肠系膜血管痉挛药物以及应用广谱抗生素,其他保守治疗包括禁食、胃肠减压、扩血管、补液、营养支持、止痛、控制血压等治疗。禁食时间取决于腹痛症状是否缓解,通常在腹痛症状完全缓解后停止禁食,嘱患者先饮水,若无问题,则进食流质饮食,最后恢复正常饮食。若患者经保守治疗后腹痛无缓解或加重,或患者有明显腹膜炎体征,有肠缺血坏死可能,SMAD动脉瘤破裂可能,则行开放手术或血管腔内介入手术治疗。手术治疗包括剖腹探查手术、肠系膜上动脉切开取栓、肠切除、球囊扩张术、置管溶栓术、支架植入术、血栓抽吸等。抗血小板治疗方案包括阿司匹林、氯吡格雷或两者兼用。抗凝治疗使用低分子肝素或利伐沙班等抗凝药物,溶栓治疗使用尿激酶进行溶栓。药物使用视患者具体情况而定,并不是所有患者都需要溶栓或抗血小板治疗。
四、随访方法
患者通过门诊随访或电话的方式进行随访。随访内容包括腹痛等症状是否缓解,出院后有无继续治疗及对应的治疗方式,是否死亡,死亡时间及原因等。
五、统计学分析
使用SPSS 26.0。正态分布的计量资料以x¯
±s表示,非正态分布计量资料以M(Q1,Q3)的形式表示。计数资料以率或构成比形式表示。计数资料间差异比较采用χ2检验或Fisher精确概率检验。用t检验或Mann-Whitney U检验比较计量资料之间的差异。采用Kaplan-Meier法计算生存率,组间差异比较采用Log-Rank检验,COX回归法进行多因素分析。P<0.05为差异有统计学意义。
结果
一、一般资料
141例SMAID患者一般特征、临床症状特征、检验结果特征见表1,SMAD组患者的平均年龄(55.76±9.87)岁明显低于其他组,男性(84.5%)明显多于其他组;ASSMA组中发生腹痛(68%)明显少于其他组,SMAE组与SMAT组的白细胞和中性粒细胞百分比、D二聚体明显高于SMAD组与ASSMA组。SMAE组肌酐91.7(66.2,125.1)μmol/L明显高于其他组。
SMAD组2例诊断时间较长(分别于4年、2年前诊断SMAD,且长期保守治疗,后因病情再次加重而住院,给予保守治疗后,1例腹痛缓解,病情好转出院,另1例局麻下行肠系膜上动脉造影+PTA,术后腹痛缓解,病情好转出院),排除此2例后,SMAD发病时间明显下降。SMAE及SMAT发病时间均明显短于ASSMA。
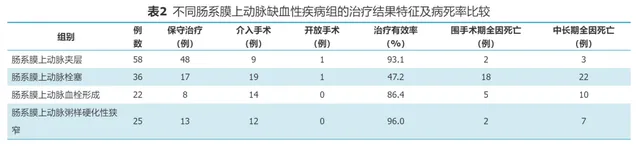
若患者临床症状明显缓解,可正常饮食,3个月内无明显反复或复发加重,影像学对比观察动脉通畅好转均视为有效。若患者腹痛无缓解、加重或出现肠坏死行肠切除手术或治疗无效死亡,均定义为治疗无效,治疗效果特征见表2。介入手术治疗SMAD的比例(15.5%)明显低于其他SMAID组,SMAE围手术期全因死亡率(50%)和中长期全因死亡率(61.1%)显著高于其他SMAID组。用Log-Rank法对四组生存时间进行检验,两两比较并对显著性水平进行Bonferroni校正,校正后的显著性水平为α=0.008 3。SMAD与其他三种SMAID的生存差异有统计学意义,ASSMA生存率显著高于SMAE(图1)。

二、SMAID全因死亡相关因素的单因素及多因素分析
单因素分析显示年龄、性别、高血压、糖尿病、冠心病、房颤、心功能衰竭、脑梗死、肾功能不全、腹膜炎体征、中性粒细胞数、中性粒细胞比例、白蛋白、肌酐、Fib、PT-INR和D-二聚体与全因死亡相关(P<0.05)。多因素COX回归分析显示老年(HR=3.855,95% CI:1.739~8.545)、中性粒细胞数(HR=1.072,95% CI:1.018~1.130)、心功能衰竭(HR=2.863,95% CI:1.332~6.154)、肌酐(HR=1.009,95% CI:1.003~1.015)、D-二聚体(HR=1.112,95% CI:1.025~1.205)是SMAID全因死亡的独立危险因素。
三、预测SMAID预后的ROC曲线分析
通过ROC曲线分析年龄、中性粒细胞数、白蛋白、PT-INR和D-二聚体对SMAID患者全因死亡的预测价值,并比较ROC曲线下面积(AUC),结果显示年龄、中性粒细胞数、白蛋白、PT-INR和D-二聚体对预测SMAID预后均有预测价值(P<0.05)。通过计算确定年龄的最佳界值64.5岁,对预测SMAID预后的敏感度78.6%,特异性60.6%;白蛋白的最佳界值38.7 g/L,对预测SMAID预后的敏感度50%,特异性80.8%;中性粒细胞数的最佳界值11.99×109/L,对预测SMAID预后的敏感度45.2%,特异性83.8%;PT-INR的最佳界值1.05,对预测SMAID预后的敏感度73.8%,特异性58.6%;D-二聚体的最佳界值1.1 μg/ml,对预测SMAID预后的敏感度73.8%,特异性75.8%。
讨论
SMAID是一种潜在的危及生命的疾病,其原因是肠道供血不足,并可并发肠梗死和坏疽。其发病率约有0.09%~0.20%,虽然总体发病率较低,但SMAID种类多,具有症状与体征分离的现象,并且部分SMAID常被误诊为急性阑尾炎、急性胰腺炎、胃肠穿孔等以急性腹痛起病的常见病[3]。极高的误诊、漏诊率耽误了最佳治疗时间,对疾病预后产生不良影响,是本病高病死率的主要原因。本单中心回顾性研究结果显示年龄、中性粒细胞数、白蛋白、PT-INR和D-二聚体是对SMAID全因死亡具有预测作用的因素;根据年龄的最佳界值64.5岁分组,确定了年龄≥65岁、中性粒细胞数、心功能衰竭、肌酐和D-二聚体是SMAID患者全因死亡的独立危险因素。
老年人因血液浓缩、血管硬化、多发心血管疾病,是SMAID的主要人群,本研究COX回归分析显示年龄≥65岁是SMAID全因死亡的独立危险因素。与Park等[4]提出的60岁以上的老年人病死率明显升高结论一致。有研究发现病死率显著增高与年龄增大(79.9比74.2岁,P<0.01)、LDH血清水平升高、白细胞增多等因素有关[5, 6]。Ozturk等[7]的研究发现将休克和酸中毒作为混杂因素排除后年龄对病死率也有影响。本研究ROC曲线分析显示年龄(AUC=0.740,95% CI:0.654~0.826,P<0.001)能预测SMAID患者的病死率;多因素COX回归分析结果显示年龄≥65岁的患者死亡风险是年龄<65岁的3.855倍(HR=3.855,95% CI:1.739~8.545)。本研究中男性70.2%,女性29.8%,男性患者明显多于女性。
在各种原因引起的SMAID中,当肠道血流量减少75%时,肠道仍可以维持正常生理功能长达12 h,但若肠供血完全中断6 h,肠道将发生不可逆损伤,出现缺血性肠坏死[8]。血便常提示持续性肠缺血[9]。梗阻初始,患者多表现为突发性、抽搐样腹痛,随着肠道灌注不足,会出现大约3~6 h的欺骗性疼痛缓解期。后随着缺血时间延长,肠道内细菌易位出现肠坏死、腹膜炎等,此时腹部症状加重,同时腹膜刺激征象开始体现[10]。
SMAID患者的高死亡率与肠坏死的发生及发展密切相关,通常导致大范围的肠切除[11]。而接受肠切除术的患者更容易出现胃肠道并发症,如吻合口漏或狭窄、腹腔内出血和感染。关于肠坏死的预测因素已有报道,包括酸中毒、白细胞增多、血清乳酸水平升高、血液浓缩、高淀粉酶血症以及中性粒细胞与淋巴细胞比值(NLR)和血小板与淋巴细胞比值(PLR)升高[12]。本研究结果显示白细胞数、中性粒细胞数和中性粒细胞比例升高与死亡率相关,中性粒细胞的AUC为0.655,最佳临界值为11.99×109/L。多因素COX回归分析表明中性粒细胞数(HR=1.072,95% CI:1.018~1.130)是SMAID全因死亡的独立危险因素。
低白蛋白血症在住院患者中很常见,并且与不良临床结果相关。在医院和社区环境中,血清白蛋白水平低的患者病死率增加[13]。Eckart等[14]的研究发现,低血清白蛋白水平、升高的CRP值能独立预测30 d病死率。本研究中ROC曲线分析显示白蛋白降低是SMAID患者病死率的预测因素(AUC=0.659,95% CI:0.556~0.762,P=0.003)。
综上所述,本研究显示SMAID好发于老年,以腹痛为主要症状,常合并有高血压等并发症,中性粒细胞数高、D-二聚体高等为其危险因素;SMAE组、SMAT组的中性粒细胞数及百分比、D二聚体明显高于SMAD组与ASSMA组。这些都有助于医务人员更快地掌握患者病情,及时采取对应的治疗。本研究也存在一些局限性:(1)本研究为回顾性研究,纳入患者均为确诊的患者,同时一部分患者由下级医院确诊后转本院治疗,对研究结果可能带来影响。(2)在急诊科就诊的患者,因一般情况较差,并常伴有其他并发症,还可能因患者家属拒绝治疗而死亡,此类数据没有被统计。(3)纳入的样本来源有限,今后仍需要进行大样本的多中心研究来更全面地分析SMAID。
参考文献
[1]
中国医师协会急诊医师分会, 解放军急救医学专业委员会, 中华医学会急诊医学分会, 等. 2020年中国急性肠系膜缺血诊断与治疗专家共识[J].中华急诊医学杂志, 2020, 29(10):1273-1281. DOI: 10.3760/cma.j.issn.1671-0282.2020.10.003.
[2]
NakamuraF, YuiR, MuratsuA, et al. A strategy for improving the prognosis of non-occlusive mesenteric ischemia (NOMI): a single-center observational study[J]. Acute Med Surg, 2019, 6(4):365-370. DOI: 10.1002/ams2.422.
[3]
AmiotA, MessingB, CorcosO, et al. Determinants of home parenteral nutrition dependence and survival of 268 patients with non-malignant short bowel syndrome[J]. Clin Nutr, 2013, 32(3):368-374. DOI: 10.1016/j.clnu.2012.08.007.
[4]
ParkWM, GloviczkiP, CherryKJ, et al. Contemporary management of acute mesenteric ischemia: factors associated with survival[J]. J Vasc Surg, 2002, 35(3):445-452. DOI: 10.1067/mva.2002.120373.
[5]
PaladinoNC, InviatiA, Di PaolaV, et al. Predictive factors of mortality in patients with acute mesenteric ischemia. A retrospective study[J]. Ann Ital Chir, 2014, 85(3):265-270.
[6]
Acosta-MeridaMA, Marchena-GomezJ, Hemmersbach-MillerM, et al. Identification of risk factors for perioperative mortality in acute mesenteric ischemia[J]. World J Surg, 2006, 30(8):1579-1585. DOI: 10.1007/s00268-005-0560-5.
[7]
OzturkS, UnverM, OzdemirM, et al. Prognostic factors in acute mesenteric ischemia and evaluation with multiple logistic regression analysis effecting morbidity and mortality[J]. Pol Przegl Chir, 2020, 93(1):25-33. DOI: 10.5604/01.3001.0014.5824.
[8]
TilsedJV, CasamassimaA, KuriharaH, et al. ESTES guidelines: acute mesenteric ischaemia[J]. Eur J Trauma Emerg Surg, 2016, 42(2):253-270. DOI: 10.1007/s00068-016-0634-0.
[9]
BabaevA, LeeDW, RazzoukL. Management of mesenteric ischemia[J]. Interv Cardiol Clin, 2014, 3(4):493-500. DOI: 10.1016/j.iccl.2014.06.005.
[10]
KlarE, RahmanianPB, BückerA, et al. Acute mesenteric ischemia: a vascular emergency[J]. Dtsch Arztebl Int, 2012, 109(14):249-256. DOI: 10.3238/arztebl.2012.0249.
[11]
ChenFF, YeXN, JiangHT, et al. Role of frailty and comorbidity status in predicting morbidity and mortality in patients with acute mesenteric ischemia[J]. Ann Vasc Surg, 2020, 67:105-114. DOI: 10.1016/j.avsg.2020.03.037.
[12]
EmileSH. Predictive factors for intestinal transmural necrosis in patients with acute mesenteric ischemia[J]. World J Surg, 2018, 42(8):2364-2372. DOI: 10.1007/s00268-018-4503-3.
[13]
FergusonRP, O'ConnorP, CrabtreeB, et al. Serum albumin and prealbumin as predictors of clinical outcomes of hospitalized elderly nursing home residents[J]. J Am Geriatr Soc, 1993, 41(5):545-549. DOI: 10.1111/j.1532-5415.1993.tb01893.x.
[14]
EckartA, StrujaT, KutzA, et al. Relationship of nutritional status, inflammation, and serum albumin levels during acute illness: a prospective study[J]. Am J Med, 2020, 133(6):713-722.e7. DOI: 10.1016/j.amjmed.2019.10.031.
平台合作联系方式
电话: 010-51322382
欢迎关注普外空间微信矩阵
普外空间订阅号
普外空间CLUB服务号
普外空间视频号
普外空间小助手











