
引言
北京大學消化腫瘤論壇暨中國胃腸腫瘤臨床研究協作組(CGOG)第十四屆年會於 2024 年 6 月 11 日至 16 日在北京成功舉辦。本次大會以「創新、共贏、卓越」為主題,緊隨國際科研前沿,采取線上線下相結合的方式,匯聚了眾多院士及學術領軍專家,共同探討消化系統腫瘤的精準治療,以及該領域最新的研究進展與面臨的挑戰。
盡管細胞療法在血液腫瘤治療方面取得了顯著成效,但在實體瘤的治療上仍面臨諸多難題。 北京大學腫瘤醫院的齊長松教授 長期致力於實體瘤細胞治療領域的研究,積累了豐富的經驗和獨到的見解。在最近結束的美國臨床腫瘤學會(ASCO)年會上,齊長松教授匯報了兩項關於 CAR-T 細胞療法的研究成果。
在今年的 CGOG 大會上,齊長松教授以 「實體瘤細胞治療進展與未來」 為主題進行了精彩的報告。
01
實體瘤細胞治療臨床研究進展
全球細胞治療趨勢
根據今年 5 月 Nat Rev Drug Discov 公布的全球細胞治療趨勢 [1] ,近 3 年來全球細胞治療熱度有所回落,尤其是 I 期前臨床研究數量回落明顯,2023 年相比 2022 年下降了 24.3%,而 II 期臨床數量依然有所上升。腫瘤類別方面,血液系統腫瘤近 3 年均呈現明顯下降趨勢,實體瘤卻依然保持每年正增長。總體而言,實體瘤的細胞治療研究依然火熱。治療方法方面,CAR-T 治療回落較快,一些新療法例如 NK 細胞療法試驗數量依然保持較快的增長狀態。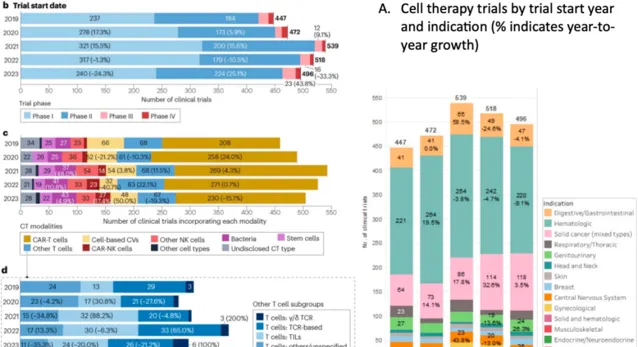
針對 Claudin18.2(CLDN18.2)的研究
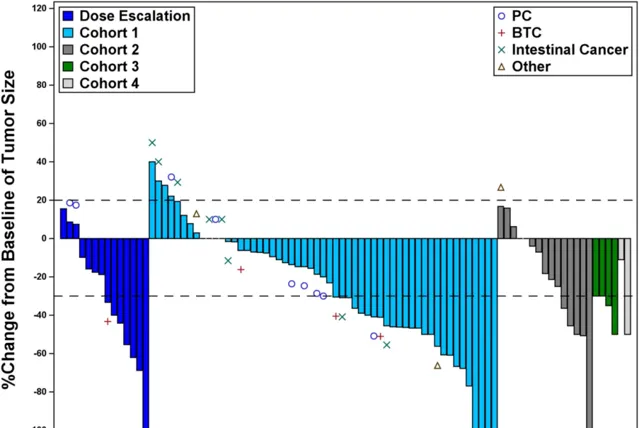
Claudin18.2(CLDN18.2)是胃腸道腫瘤細胞表面廣泛表達的一個重要分子靶標。自體靶向 CLDN18.2 CAR-T 細胞療法 Satri-cel(又稱 CT041)已在胃腸道腫瘤患者中開展了相應的臨床研究,中期結果已於 2022 年 6 月公布。今年 ASCO 和 Nature Medicine 雜誌報告了其最終結果 [2] 。這是一項單臂、開放標簽的 I 期臨床試驗,旨在評估 Satri-cel 在 Claudin18.2 陽性的晚期消化系統腫瘤患者中的安全性和有效性。試驗包括劑量遞增階段和劑量擴充套件階段的 4 個佇列:佇列 1,納入標準治療失敗的消化道腫瘤患者接受 CT041/satri-cel 單藥治療(n = 61);佇列 2,納入標準治療失敗的消化道腫瘤患者接受 CT041/satri-cel 聯合 PD-1 單抗(特瑞普利單抗)治療(n = 15);佇列 3,在 GC/GEJ 患者一線治療後未進展的情況下,將 CT041/satri-cel 作為序貫治療(n = 5);以及佇列 4,既往 CLDN18.2 單抗治療失敗的 GC/GEJ 患者接受 CT041/satri-cel 單藥治療(n = 2)。

從 2019 年 3 月 26 日至 2022 年 1 月 21 日,98 例患者接受了至少一次 CT041/satri-cel 輸註。療效方面結果顯示,在不同的佇列、不同的瘤種中,CT041 的有效性都是非常確切的。所有患者(n = 98)的客觀緩解率(ORR)和疾病控制率(DCR)分別達到 38.8% 和 91.8%,但 CT041 聯合 PD-1 治療佇列相比 CT041 單藥治療佇列的 ORR 有所下降。所有患者的中位無進展生存期(PFS)和中位總生存期(OS)分別為 4.4 個月(3.7~6.6 個月)和 8.8 個月(7.1~10.2 個月)。在接受 CT041 單藥治療的療效可評估的胃癌患者中,有可測量病竈患者(n = 47 例)的 ORR 和 DCR 分別達 57.4% 和 83.0%,所有療效可評估的胃癌患者(n = 55)的中位 PFS 和中位 OS 分別為 5.8 個月(4.2~8.4 個月)和 9.7 個月(7.1~14.4 個月)。
針對 MSLN 的研究
MSLN 又稱間皮素,MSLN 蛋白在 85%-90% 的間皮瘤、80%-85% 的胰臟癌和 60%-65% 的肺癌、卵巢癌和膽管癌中均有表達。
在 ASCO、ESMO 報道及 2023 年 Nat Med 釋出的一項靶向 MSLN 的 TRuC-T 細胞療法 gavo-cel 治療難治性實體瘤的 1/2 期臨床試驗結果 [5] 發現,30 例可評估的患者中,ORR 為 20%(13% 確認),DCR 為 77%,6 個月的 OS 率為 70%,mOS 為 10.6 個月。其中一名患有轉移性上皮樣惡性胸膜或腹膜間皮瘤(MPM)患者在第 25 天 CT 掃描顯示,腫瘤腫塊的大小顯著減小,隨後幾乎完全消退。
總體而言,TRuC-T 細胞療法在間皮瘤和卵巢癌患者中顯示出了值得期待的療效,但在其他腫瘤中有效性和安全性結果並不樂觀。
針對 GUCY2C 的研究
鳥苷酸環化酶 C(GUCY2C)又稱 GC-C 或 STa 受體/STaR,是一種在腸上皮細胞上表達的跨膜受體,屬於鳥苷酸環化酶家族。研究表明 GC-C 在原發性結直腸癌細胞中穩定表達,而在轉移性結直腸癌細胞中 GC-C 的表達是正常腸上皮細胞的 2~10 倍,並且約 80% 的結直腸癌患者腫瘤中的 GC-C 表達為陽性,這為 CAR-T 細胞治療提供了新的可能性。
IM96 作為一種針對 GUCY2C 的 CAR-T 療法,在初步的臨床試驗中已顯示出良好的安全性和一定的療效。2024 年 ASCO 年會上,GUCY2C CAR-T 療法 IM96 治療轉移性結直腸癌研究更新了 20 例患者的研究結果數據 [6] 。結果顯示在 19 例可評估療效的患者中,DCR 為 73.7%,ORR 為 26.3%。在 DL3 組中,無論是否發生肝轉移,患者的 ORR 為 40.0%。DL3 組的中位 PFS 為 7 個月,中位緩解持續時間(DoR)為 10 個月。在 6 個月內沒有緩解的患者出現疾病進展。所有患者的腫瘤緩解與癌胚抗原(CEA)水平顯著降低相關。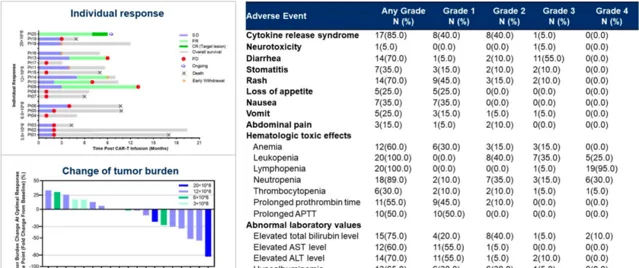
針對 GPC3 的研究
GPC3 是一種在肝癌中過表達的表面抗原,在健康組織中幾乎不存在。C-CAR031 是一種 GPC3 靶向的自體 CAR-T 療法,同時「裝備」了 TGFβ 以抵抗免疫抑制微環境並增強其效力。在今年 ASCO 年會中,C-CAR031 療法的一項最新臨床研究 [7] 公布了結果。研究共納入 24 例 GPC3 陽性晚期肝細胞癌患者,這些患者曾接受 ≥1 線全身治療並行生疾病進展。患者在經過標準淋巴細胞清除後接受單次靜脈輸註 C-CAR031。主要終點是安全性和耐受性,其他終點包括藥代動力學和初步療效。試驗結果顯示,在 22 例可評估療效患者中,有 90.9% 的患者出現肝內與肝外的腫瘤縮小,中位縮小振幅為 44.0%(範圍:3.4-94.4%)。接受所有劑量水平治療患者的 DCR 為 90.9%,ORR 為 50.0%。接受劑量水平 4 的患者 ORR 達 57.1%。 圖 6:研究結果
[7]
圖 6:研究結果
[7]
針對 CEA 的研究
癌胚抗原(CEA)作為一種廣譜腫瘤標誌物,在結直腸癌中的表達明顯升高,而 CEA CAR-T 細胞療法便是以 CEA 為靶點設計的一種治療轉移性結直腸癌患者的 CAR-T 療法。
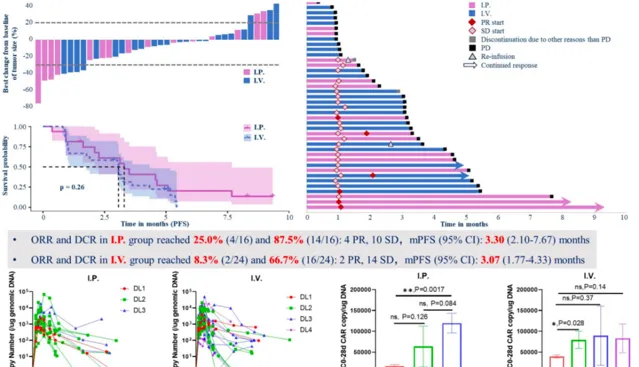
在今年 ASCO 年會上公布了一篇由國內學者主導的一項關於缺氧反應型 CEA CAR-T 細胞療法靜脈/腹腔給藥治療復發難治實體瘤患者的療效與安全性的 I 期臨床研究 [8] 。研究共納入了 40 例 CEA+難治性實體瘤患者,按照輸註方式的區別將入組患者分為了腹腔註射(IP 組,n = 16)和靜脈註射(IV 組,n = 24)2 個亞組,並分別設定了劑量探索和劑量拓展階段。分組由研究者根據患者臨床實際狀況及未來獲益進行綜合評估後決定。劑量遞增階段按照「3+3」設計,初步評估輸註後的安全性及有效性,從低劑量起始逐漸遞增,最終由研究者評估得出推薦劑量。研究結果顯示,IP 組較 IV 組在 ORR(25% vs. 8.3%)和 DCR(87.5% vs. 66.7%)上都取得了明顯優勢。此外,在 IP 組還觀察到了緩解時間在 5 個月以上的長程緩解,其中一名患者在 6 個月的隨訪中靶病竈消退了 75.98%,大大提升了患者的生活質素。
針對 CLDN6 的研究
CLDN6 是發育調節緊密連線蛋白,在人類中,CLDN6 轉錄水平在胎兒的胃、胰腺、肺和腎組織中較高,但在相應的成人組織樣本中,透過定量 RT-PCR 分析了來自 50 多種成人組織類別的 160 多份非癌性健康人體樣本,排除了 CLDN6 轉錄水平的表達。此外,經免疫組化染色檢測,在成人正常組織類別中均未檢測到 CLDN6 蛋白的表達。研究發現 CLDN6 高轉錄水平的現象在各種人類實體瘤如睪丸癌、卵巢癌、子宮內膜癌和肺腺癌中都很常見,免疫組化染色顯示 CLDN6 蛋白在這些人類癌癥中呈現高水平細胞膜表達且異質性低,這些發現表明,CLDN6 在正常的人體組織中被精確的、完整的沈默,暗示著 CLDN6 是一種嚴格的癌胚細胞表面抗原,具有理想 CAR-T 細胞靶標的特性。
2023 年 Nat Med 公布了靶向 CLDN6 的 CAR-T 細胞聯合或不聯合編碼 CLDN6 的 CAR-T 細胞擴增 mRNA 疫苗(CARVac)治療 CLDN6 陽性復發或難治性晚期實體瘤患者的 1/2 期臨床數據 [9] 。結果顯示,CARVac 疫苗聯用可以顯著增強腫瘤病人的 ORR 以及 DCR。CARVac 疫苗的使用似乎可以上調 CAR-T 細胞表面細胞因子受體的表達。在 21 例可評估療效的患者中,CLDN6 CAR-T 細胞單獨或聯合 CARVac 的最佳 ORR 為 33%,DCR 為 67%,其中 1 例患者達到了完全緩解,6 例患者部份緩解,7 例患者病情維持穩定,5 例患者病變縮小可量化。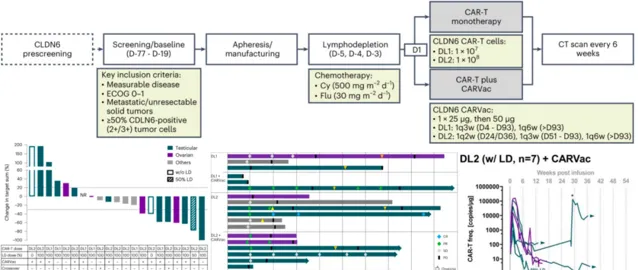
針對 ADP-A2M4CD8 的研究
ADP-A2M4CD8 是新一代 TCR-T 療法,又稱特異性肽增強親和力受體(Specific Peptide Enhanced Affinity Receptor, SPEAR)T 細胞療法,旨在透過表達 CD8α 輔助受體提高療效,與 T 細胞受體一起進行基因工程改造,增加 CD4 陽性 T 細胞的效力。研究人員推測,這種療法將增加 T 細胞受體結合親合力,增強 CD4 陽性工程 T 細胞對 MAGE-A4 腫瘤的多種功能反應。
2023 ESMO 年度大會上公布了 ADP-A2M4CD8 的 1 期 SURPASS 臨床試驗(NCT04044859)的臨床和轉化數據 [10] 。51 例以黑色素瘤、非小細胞肺癌、卵巢癌、胃食道癌、頭頸部癌或尿路上皮癌為主的患者接受了 1.02-9.95 x 10 9 ADP-A2M4CD8 T 細胞移植。結果顯示,45 例單一治療患者根據 RECIST v1.1 評估的總有效率為 35.6%(2 例 CR,14 例 PR),中位有效時間為 20.79 周(95%CI:11.6-30.9)。26 例卵巢癌、尿路上皮癌和頭頸癌的單一治療組患者有效率為 50%。相比單藥治療組,聯合納武利尤單抗組未展現出更好的療效,反而有所下降。因而細胞療法與免疫療法聯合治療策略是否合適仍需進一步探索。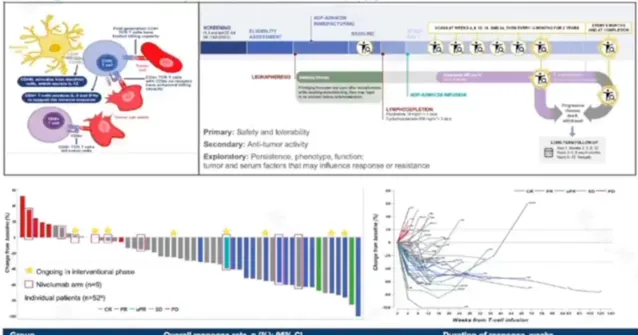
圖 9:SURPASS 研究設計及結果;圖源:講課 PPT
02
實體瘤細胞治療的問題與方向
實體瘤細胞治療的臨床前基礎研究和臨床研究之間依然存在較大的脫節,雖然針對實體瘤細胞治療的臨床前研究更新頻率非常快,但真正能轉化成臨床研究的比例非常低。但總體來看,實體瘤的細胞治療還是不斷進步的。3-5 年前實體瘤細胞療法的療效比較差,中位的 ORR 僅為 10% 左右,如今多個實體瘤細胞療法的 ORR 已超過 30%,達到「及格線」。總結「及格」的相關臨床研究,發現其需滿足以下條件:
靶點的表達明確,強度、比例篩選合理,靶點異質性較弱;
必須行清淋預處理,但清淋方案和強度仍需探索;
對合適人群進行人工篩選,篩選條件包括腫瘤負荷、轉移器官、基因狀態。
ORR 的提升僅初步證明了靶點具備發展潛力,然而,我們仍需深入驗證 PFS 乃至 OS 結果來全面評估其療效。從整體來看,實體瘤的細胞療法在生存獲益方面與成熟的血液腫瘤細胞療法相比仍然差距顯著。當前,多數實體瘤細胞療法的中位 PFS 通常只有 4-5 個月,這表明在提升實體瘤細胞療法的生存獲益方面,我們仍然面臨著巨大的挑戰。
聯合治療方案方面: 多項臨床研究發現 PD-1 單抗聯合治療未提高細胞治療的療效,但尚無法從作用機制角度闡述其相關原理;另外,聯合疫苗、靶向治療、溶瘤病毒的相關臨床研究正在開展中,如何設計其標準臨床試驗仍需探索。
回輸路徑方面: 非靜脈的回輸途徑在某些腫瘤治療中展現出增加療效、減少不良反應的潛力,未來我們需要針對不同類別的實體瘤、不同的疾病狀態以及不同的轉移狀態開展相關臨床研究,以進一步確定不同患者群體適合的回輸路徑。
臨床試驗設計方面: 考慮到 CAR-T 較長的制備時間可能導致患者治療延遲進而增加試驗失敗的風險,可嘗試將患者的單采提前。
安全性方面: 研究者應該重點關註脫靶效應(On-Target off tumor)導致的相關毒性,CEA-CAR-T 導致的嚴重結直腸炎、MSLN-CAR-T 導致的肺毒性致死病例均有報道。
其他問題還包括靶點選擇、制備時間、療效評估、腫瘤異質性、免疫微環境、耐藥機制等等。
近幾年 ADC 類藥物發展迅速,很快成為腫瘤藥物發展最火的賽道,今年 ASCO 也報道了一項針對 Claudin18.2 的 ADC 類藥物 CMG901(AZD0901)治療晚期胃癌/胃食管結合部腺癌患者的 I 期研究的更新結果 [11] ,三個劑量組共 89 例可評估的 Claudin18.2 高表達受試者的確認 ORR 為 35%,確認 DCR 為 70%,其療效與 Claudin18.2 細胞療法相當。相比 ADC 藥物,Claudin18.2 細胞療法有以下優勢:療效方面略優;不影響患者長期生存質素;僅需 1 次就可帶來長期獲益;患者更容易回歸社會;可以根據患者情況進行無限改造,因而具有將患者治愈的巨大潛力。參考文獻
[1] Ana Rosa Saez-Ibañez, Samik Upadhaya, Tanya Partridge, et al., The changing landscape of cancer cell therapies: clinical trials and real-world data [J] Nat Rev Drug Discov.2024 May 31. doi: 10.1038/d41573-024-00094-4.
[2] Changsong Qi, Chang Liu, Jifang Gong, et al., Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial final results [J] Nat Med. 2024 Jun 3. doi:10.1038/s41591-024-03037-z.
[3] Changsong Qi, Panpan Zhang, Chang Liu, et al., Safety and Efficacy of CT041 in Patients With Refractory Metastatic Pancreatic Cancer: A Pooled Analysis of Two Early-Phase Trials [J] J Clin Oncol. 2024 May 24:JCO2302314. doi: 10.1200/JCO.23.02314.
[4] Changsong Qi, Tong Xie, Jun Zhou, et al., CT041 CAR T cell therapy for Claudin18.2-positive metastatic pancreatic cancer [J] J Hematol & Oncol. 2023 Sep 9;16(1):102. doi: 10.1186/s13045-023-01491-9.
[5] Hassan, R., Butler, M., O』Cearbhaill, R.E. et al. Mesothelin-targeting T cell receptor fusion construct cell therapy in refractory solid tumors: phase 1/2 trial interim results. Nat Med (2023).
[6] Qi C, et al,. Phase I study of GUCY2C CAR-T therapy IM96 in patients with metastatic colorectal cancer. ASCO 2024. Abstract 2518.
[7] Qi Zhang, et al,. Phase I study of C-CAR031, a GPC3-specific TGFβRIIDN armored autologous CAR-T, in patients with advanced hepatocellular carcinoma (HCC). ASCO 2024. Abstract 4019.
[8] Huangyu Zhang, et al,. Phase I trial of hypoxia-responsive CEA CAR-T cell therapy in patients with heavily pretreated solid tumor via intraperitoneal or intravenous transfusion. ASCO 2024. Abstract 3514.
[9] Mackensen, A., Haanen, J.B., Koenecke, C. et al. CLDN6-specific CAR-T cells plus amplifying RNA vaccine in relapsed or refractory solid tumors: the phase 1 BNT211-01 trial. [J] Nat Med. 2023 Nov;29(11):2844-2853. doi: 10.1038/s41591-023-02612-0. Epub 2023 Oct 23.
[10] Next-Generation TCR T-cell Therapy (ADP-A2M4CD8) Demonstrates Strong Efficacy in a Broad Range of Solid Tumors; Adaptimmune Presents Data Update from its SURPASS trial at ESMO.
[11] Xu R,et al. A Phase 1 Trial of Claudin 18.2-Specific Antibody-Drug Conjugate CMG901 in Patients with Advanced Gastric/Gastroesophageal Junction Cancer.2024 ASCO. Abstract 434420.
編輯:lsh;題圖:丁香園創意團隊











