來 源 :吳恩慧,章建華,張 琳,李清林,王 玲,尹 華.基於UPLC-Q-TOF-MS代謝組學技術研究淫羊藿-川芎對骨關節炎大鼠的調控作用 [J]. 中草藥, 2023, 54(22): 7445-7453.
骨關節炎(osteoarthritis,OA)是一種以關節軟骨的退行性病變和繼發性骨質增生為主要病變的慢性關節疾病,以關節疼痛、滑膜炎癥和活動受限為主要表現[1]。目前化學藥治療以緩解疼痛、抗炎或改善功能狀態為主,但不良反應明顯,不宜長期套用,因此尚缺乏切實有效的治療手段和藥物[2]。中醫臨床多以「補腎活血」為治療準則[3],常以出自【太平聖惠方】的補腎活血藥對淫羊藿-川芎配伍使用。淫羊藿補腎壯陽而治腎虛之根本,入肝腎祛風濕強筋骨;川芎活血祛瘀、祛風止痛治療血瘀氣滯[4-5]。
OA疾病發展過程及其治療與代謝密切相關,代謝組學的研究可用於發現疾病的發病機制及探究藥對幹預下的調控機制[6-8]。研究表明,在OA發展過程中,軟骨細胞代謝發生改變,基質金屬蛋白酶-13(matrix metalloproteinase-13,MMP-13)參與軟骨的降解,滑膜細胞和軟骨細胞局部合成的促炎細胞因子白細胞介素-1β(interleukin-1β,IL-1β)和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)造成關節軟骨持續損傷[9-11]。藥理研究表明,淫羊藿可調節軟骨細胞代謝,促進軟骨基質合成和細胞增殖[12-13]。川芎的有效成分可抑制炎癥因子IL-1β、TNF-α、MMP-13的表達[14-15]。
淫羊藿-川芎對OA的作用機制尚不清楚,因此本研究基於超高效液相色譜-四極桿-飛行時間質譜聯用儀(ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF-MS)的代謝組學方法考察淫羊藿-川芎配伍及其單藥治療OA的內源性代謝產物變化及代謝輪廓,明確其發揮藥效的代謝調控通路。
病理結果
OA模型大鼠關節軟骨組織病理學經時評價
如圖1所示,正常組及假手術組關節面光滑平整,顏色紅潤鮮艷,SO著色均勻,軟骨細胞排列整齊,四層結構及潮線清晰可見。造模第2周模型組大鼠關節軟骨較正常組無明顯變化,僅在軟骨層表面有較小、淺的裂隙;第4周關節軟骨層變薄,表面粗糙,局部軟骨出現片狀脫落,部份軟骨基質不著色;第6周關節軟骨層嚴重破壞,各層軟骨細胞簇集生長,排列紊亂;第8周病變加劇,可見軟骨細胞壞死,潮線更加不規則或完全消失,甚至可見軟骨下骨暴露。提示第6周OA模型建立成功。
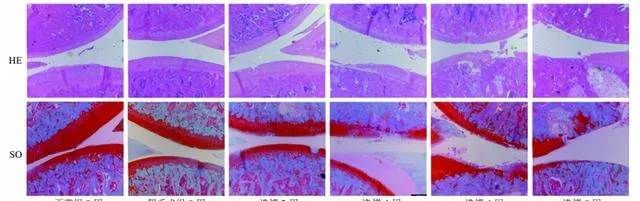
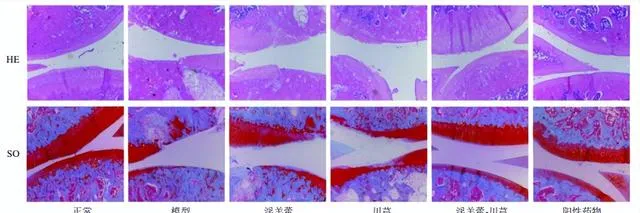
淫羊藿-川芎對OA大鼠膝關節組織病理學的影響
如圖2所示,正常組關節面光滑平整,顏色紅潤,軟骨細胞排列整齊,四層結構及潮線清晰可見,SO著色均勻,顏色鮮艷。模型組關節軟骨層明顯變薄,軟骨部份脫落,軟骨細胞簇集,排列紊亂,潮線多不完整或完全消失,SO著色重度減弱,可見壞死崩解細胞,甚至可見軟骨下骨質外露。各給藥組軟骨細胞排列有序,軟骨細胞聚集生長現象逐漸消失,軟骨層逐漸恢復。
淫羊藿-川芎組和陽性藥物組關節軟骨層光滑,無明顯軟骨細胞聚集,SO著色均勻,但陽性藥物組軟骨細胞內可見大量脂肪滴。淫羊藿組軟骨層表面有輕微裂縫,未見明顯軟骨脫落,軟骨細胞排列較為整齊,但存在細胞聚集;川芎組軟骨層薄且脫落明顯,淫羊藿組和川芎組均存在失染現象,但淫羊藿組較川芎組軟骨層厚,軟骨細胞簇集程度較弱。說明淫羊藿、川芎及其配伍、陽性藥物均對OA有治療作用。淫羊藿-川芎配伍治療效果與陽性藥物相似,較單用更佳。
MMP-13結果
OA模型大鼠血漿中MMP-13水平經時評價
如表1所示,與正常組比較,假手術組MMP-13水平無明顯差異,模型組造模2周後MMP-13水平顯著升高( P <0.05、0.01)。
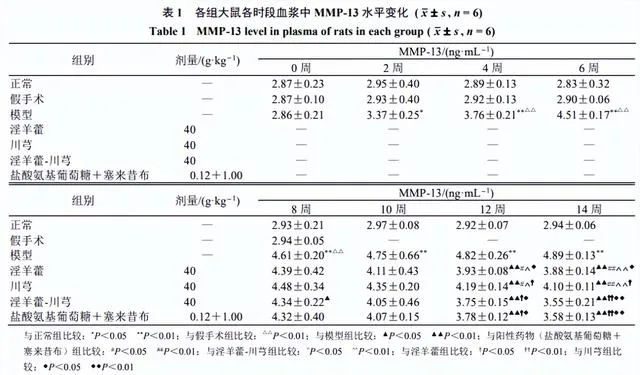
單藥及配伍對OA大鼠血漿中MMP-13水平的影響
各給藥組於第12、14周的MMP-13水平較同時期模型組有顯著性差異( P <0.01)。淫羊藿-川芎組和陽性藥物組血漿中MMP-13水平顯著低於淫羊藿組和川芎組( P <0.05、0.01)。說明陽性藥物組、淫羊藿、川芎與淫羊藿-川芎均有治療OA的作用,且配伍使用效果較好。
代謝組學分析
OA大鼠模型代謝組學分析
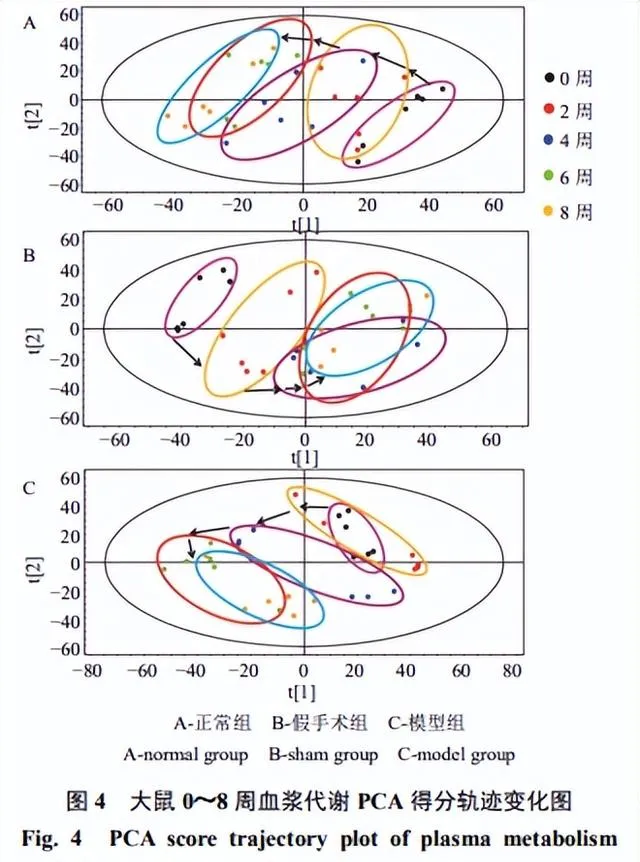
各組大鼠0~8周血漿代謝動態反映了OA的發展,如圖3所示,第0、2周,3組血漿樣本代謝無明顯變化,第4、6、8周,3組樣本均呈現分離趨勢,假手術組的趨勢更接近模型組。正常組大鼠未進行任何手術,6周的代謝變化只反映了大鼠正常衰老的情況;而假手術組模仿OA模型組大鼠實施了手術,體現了創傷對機體內源性成分的影響,其代謝變化由大鼠正常衰老和手術創傷共同作用產生。因此,在進行OA代謝組學研究時,以假手術組作為空白對照組更為合理。
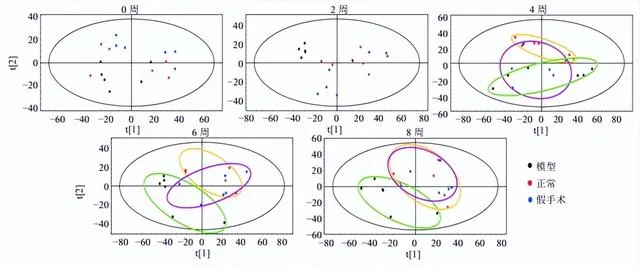
如圖4所示,正常組呈現一定的代謝變化趨勢,可能是大鼠正常衰老的生理變化。假手術組較正常大鼠0~2周分離趨勢較明顯,4~8周變化趨於緩和,可能與手術創傷及機體自身修復有關。模型組造模前後樣本分離明顯,隨著時間的推移,第4~8周呈現有規律的分離,OA大鼠內源性代謝產物較正常組有明顯變化。第4~6周變化最明顯,第6~8周趨於穩定,說明第6周OA模型建立成功。
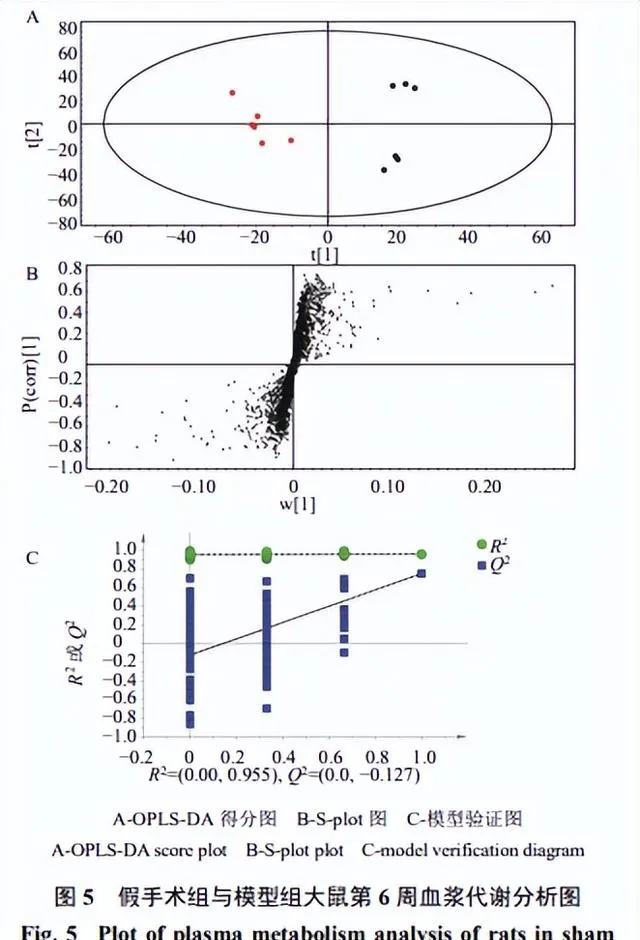
為了使組間差異最大化,消除組內變異對分類的負面影響,建立模型組和假手術組的OPLS-DA模型(圖5),模型組和假手術組能明顯分開,兩者在代謝產物方面具有明顯差異。在200次叠代中套用排列檢驗,說明沒有過擬合。
給藥組大鼠代謝組學分析
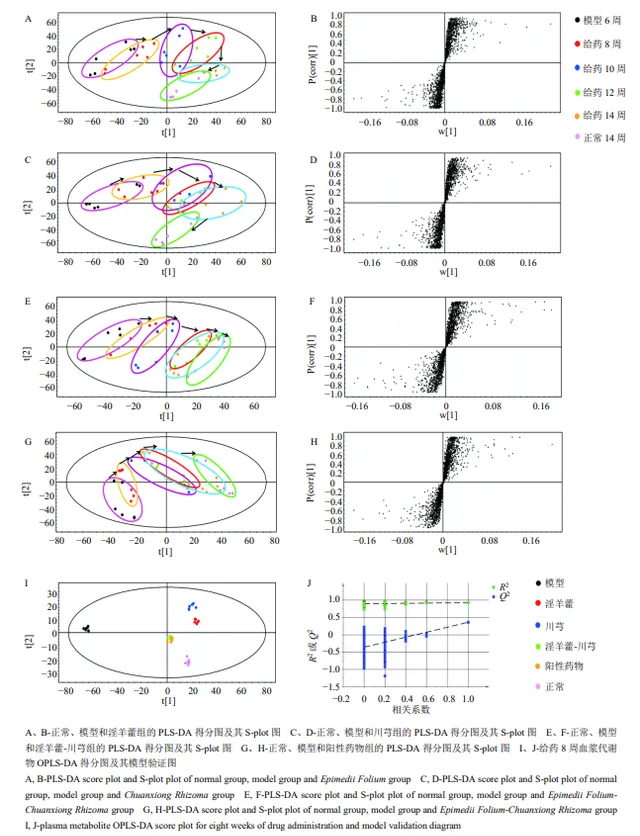
如圖6-A~H所示,各給藥組於第10~14周與模型組達到分離,並逐漸向正常組靠攏,在第14周趨勢最為明顯。說明各給藥組均可調控其向正常狀態轉變,其中淫羊藿-川芎組和陽性藥物組調控作用明顯優於單藥。各給藥組OPLS-DA圖(圖6-I、J)顯示,淫羊藿-川芎和陽性藥物組療效優於淫羊藿和川芎單藥,進行了模型驗證,顯示 Q 2截距小於0,未過擬合,模型可靠,初步闡明「補腎活血」法治療OA的科學性。
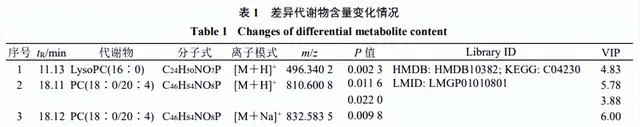
血漿潛在生物標誌物的篩選
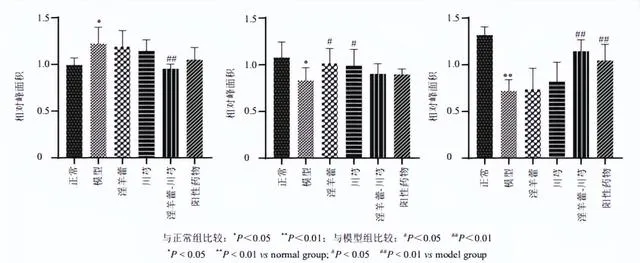
結合OPLS-DA模型的VIP值及 P <0.05篩選出OA模型中69種差異表達代謝物。透過建立第8周和第14周各給藥組樣本的S-plot圖,從淫羊藿組、川芎組、淫羊藿-川芎組和陽性藥物組中篩選出16種差異表達代謝物,鑒定出2個潛在的生物標誌物(表1和圖7)。Lyso PC(16∶0)水平下調,該生物標誌物僅受淫羊藿-川芎的調控,提示淫羊藿與川芎聯合用藥可能增強對OA代謝物的調控。
血漿的代謝通路分析
潛在的生物標誌物屬於甘油磷脂,如LysoPC、PC,與磷脂代謝通路相關,代謝途徑可能為OA的發病機制及淫羊藿-川芎對OA大鼠作用機制提供依據。
討論
本研究采用UPLC-Q-TOF-MS技術經時評價OA造模過程中血漿內源性代謝物和MMP-13水平的動態變化,直觀揭示了OA大鼠模型在代謝層面的發病軌跡,有助於為OA的早期診斷提供依據。研究了淫羊藿-川芎配伍對OA大鼠代謝的調控作用,給藥後各組代謝輪廓變化及回呼,其結果與組織病理學和MMP-13評價的藥效作用一致,證明了其配伍治療OA的合理性。初步獲得2個生物標誌物,分別為LysoPC(16∶0)和PC(18∶0/20∶4),與磷脂代謝通路相關。
課題組前期考察淫羊藿-川芎不同配比(1∶1、1∶2、2∶1)對OA大鼠的藥效作用,病理組織學(HE、SO染色),MMP-13、IL-1β檢測結果表明淫羊藿、川芎以1:1配伍使對OA大鼠的藥效作用最佳。故選擇淫羊藿-川芎(1∶1)研究其配伍機制。
經時評價OA造模過程中,第6周OA模型建立,第8周OA病變進一步加重。一般藥物幹預主要對早期和中期OA有效。為體現OA早期診斷、早期治療的理念,本研究選擇造模後6周進行藥物幹預研究。隨著造模時間的延長,模型組大鼠血漿中MMP-13表達水平逐步升高,提示可將MMP-13的表達水平作為評價OA模型建立的一個評價指標。給藥後,各給藥組血漿中MMP-13水平隨給藥時間的延長而逐步降低,提示MMP-13水平可用於療效評價。
本研究初步獲得2個生物標誌物,分別為LysoPC(16:0)和PC(18∶0/20∶4),LysoPCs和PCs是脂質雙分子層的組成部份,可以調節跨膜訊號傳導[18]。OA與磷脂的結構和濃度的變化密切相關。PCs的缺乏,特別是含有長鏈脂肪酸的不飽和PCs,可能會增加摩擦並導致關節軟骨損傷[19]。PCs可透過磷脂酶A2(PLA2)水解生成LysoPCs,而OA軟骨細胞中PLA2的高表達可促進IL-1β、TNF等炎性因子的表達[20-21]。
Zhang等[22]研究發現,LysoPCs與PCs的比率可用於預測OA,與正常人相比,OA患者血漿中LysoPCs水平較高,PCs水平較低。氧化應激反應也可導致OA,當活性氧存在時,可以促使PCs轉化為LysoPCs[23]。OA軟骨細胞、滑膜成纖維細胞和脂肪細胞均可產生造成機械、生化刺激的活性氧和一氧化氮。嗜中性球可以透過釋放蛋白水解酶混合物以結合活性氧,導致軟骨組織破壞[24-26]。
本研究從代謝組學層面初步揭示淫羊藿-川芎對OA大鼠的作用機制,證明其配伍合理性,動態監測OA進展和淫羊藿-川芎治療情況的結果,為探索中醫藥治療OA代謝組學的潛在療效和機制提供了更有效的途徑。











