在2024年歐肝會上(EASL2024),研究人員介紹了新型反義寡核苷酸(ASO)AHB-137在健康誌願者和慢性乙肝患者中的安全性和抗病毒活性數據。

在研乙肝新藥AHB-137,1期研究初步數據,在2024歐肝會更新
AHB-137是一種新型裸露反義寡核苷酸 (ASO),靶向乙型肝炎病毒(HBV)mRNA 3′末端附近的高度保守序列。在臨床前研究中,AHB-137表現出了良好藥代動力學(PK)和安全性特征以及強大抗病毒活性。今年歐肝會,研究人員更新了AHB-137在健康誌願者(HVs)和慢性乙型肝炎(CHB)受試者中進行的兩項 I 期臨床研究安全性和初步療效結果。
有40名健康誌願者在第1、4、8、15和22天接受單劑量高達450毫克的AHB-137或多劑量300毫克AHB-137。共有52名已接受穩定核苷類藥物(NA)的乙型肝炎e抗原(HBeAg)陰性慢性乙肝受試者,並在4周內接受最多6次劑量為150毫克AHB-137或300毫克AHB-137。所有劑量均為皮下註射。
有35名CHB受試者的基線乙肝表面抗原(HBsAg)水平< 1,000 IU/ml,有17名CHB受試者(HighS受試者)的基線乙肝表面抗原(HBsAg)水平介於1,000至10,000 IU/ml之間。

研究結果顯示,所有健康誌願者均順利完成研究。未發生4級不良事件(AEs),未發生因不良事件而停藥,也未發生與研究藥物相關的嚴重不良事件(SAE)。總體而言,有30名健康誌願者(75%)經歷了治療相關不良事件(TRAEs)。
除1例3級註射部位紅斑外,所有TRAEs均為1級或2級。最常見的TRAEs(發生率>1例)為註射部位反應、頭痛、惡心、發熱和肌痛。入組的CHB受試者年齡在26-63歲之間,大多數為男性(81%)和亞洲人(92%)。迄今為止,共有37名CHB 受試者完成了至少第29天的隨訪。
其中,8 名和 18 名 HBsAg <1,000 IU/ml 的 CHB 受試者分別使用了 150 毫克和 300 毫克的 AHB-137,11 名 HighS 受試者使用了 300 毫克的 AHB-137。使用 150 毫克時,37.5% 的受試者(3/8)的 HBsAg 降幅大於 1 log10 IU/ml;使用300 毫克時,55.6% 的受試者(10/18)的 HBsAg 降幅大於 1 log10 IU/ml;
使用 300 毫克時,45.4% 的 HighS 受試者(5/11)的 HBsAg 降幅大於 1 log10 IU/ml。使用 150 毫克的受試者中有 12.5%(1/8)、使用 300 毫克的受試者中有 33.3%(6/18)、使用 300 毫克的 HighS 受試者中有 36.4%(4/11)的 HBsAg 降幅大於 2 log10 IU/ml。
迄今為止,5 名受試者在接受為期 4 周的 AHB-137 治療後,HBsAg 持續下降(HBsAg 低於定量下限),其中有 2 人實作了血清轉換(可檢測到乙肝表面抗體 (HBsAb))。第 29 天至第 50 天期間,HBsAg 下降振幅最大。
研究結論:在健康誌願者和慢性乙肝受試者中,連續4周使用單劑量(最多450毫克)和多劑量(最多300毫克)的AHB-137通常具有良好的安全性和耐受性。在基線HBsAg<10,000 IU/ml的CHB受試者中,超過30%受試者的乙肝表面抗原水平下降振幅超過 2 log10 IU/ml,並且在AHB-137治療4周(300毫克)後,可導致乙肝表面抗原水平持續下降。AHB-137的單藥療法與經NA治療背景在實作功能性治愈CHB方面表現出良好潛力。
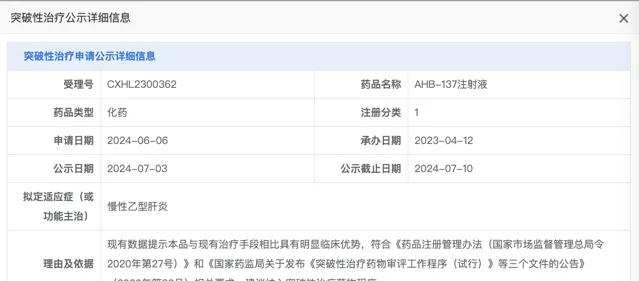
來源:CDE
小番健康結語:AHB-137已被中國藥品監督管理局(NMPA)藥品評審中心(CDE)納入突破性治療藥物(BTD)品種名單,針對適應癥為慢性乙型肝炎。
本屆歐肝會,研究人員更新了與AHB-137相關的兩項最新1期數據,以上是其中一份。AHB-137在中國的第2a期臨床研究已於今年6月開始,並已完成患者入組。AHB-137在中國開展的1b期研究已完成。全球1b期研究患者入組工作已結束。
AHB-137 是在浩博醫藥(AusperBio)專有的 Med-Oligo™ ASO 技術平台上開發的一種新型非共軛反義寡核苷酸 (ASO),這種新型雙機制 ASO 目前正在多個國際研究機構同時進行 1b 期試驗,並在中國進行 2 期試驗。











