羅切斯特大學(University of Rochester)和哥本哈根大學(University of Copenhagen)的研究人員開發了一種生物發光成像技術,可以建立小鼠大腦中氧氣運動的高度詳細且視覺上引人註目的影像。該技術提供了一種更多地了解腦氧張力( P O2),一種動態變化但尚不清楚的腦組織中氧氣輸送和需求的量度。研究人員認為,這種方法可以很容易地被其他實驗室復制,將使研究人員能夠更精確地研究大腦中缺氧的形式,例如在中風或心臟病發作期間發生的大腦缺氧。
該團隊的實驗,包括監測清醒小鼠的氧氣,提供了關於為什麽久坐不動的生活方式可能會增加患阿爾茨海默氏癥等疾病風險的見解。「這項研究表明,我們可以在大腦的廣泛區域連續監測氧氣濃度的變化,」位於羅切斯特大學和哥本哈根大學的轉化神經醫學中心(CTN)聯合主任Maiken Nedergaard醫學博士說。「這為我們提供了即時大腦中發生的事情的更詳細的圖片,使我們能夠辨識以前未檢測到的暫時性缺氧區域,這些區域反映了可能引發神經功能缺損的血流變化。
Nedergaard及其同事在 【科學】雜誌上 發表了一篇題為「小鼠大腦皮層缺氧口袋的氧氣成像」的論文。
人腦消耗大量的能量,這些能量幾乎完全來自一種需要氧氣的新陳代謝形式。「人類大腦在休息時使用約20%的全身耗氧量,」作者寫道。「氧氣的輸送和需求(O2)是如此精細的平衡,以至於維持組織氧合可能是所有大腦功能中最關鍵的。但是,盡管已知氧氣的有效和及時輸送對健康的大腦功能至關重要 - 「在腦血流停止後幾秒鐘內失去意識,」研究小組指出 - 這個過程的確切機制在很大程度上仍然是未知的。
科學家對腦組織氧張力動力學的理解( P O2)在生理條件下受到限制,主要是因為缺乏空間精確的 P O2測量技術成像,團隊繼續說道。「目前,組織 P O2可以透過磷光和克拉克型電極進行測量。這兩種方法都不能提供足夠高的時空靈敏度來檢測皮質 P O2 的生理變化".
為了解決這些局限性,該團隊開發了一種新技術,該技術采用了一種基因編碼的生物發光氧指示蛋白,這是在螢火蟲中發現的生物發光蛋白的化學表親。這種蛋白質已被用於癌癥研究,是使用一種病毒產生的,該病毒向細胞傳遞指令以酶的形式產生發光蛋白質。當酶遇到第二種化合物,一種稱為呋喃嗪的受質時,化學反應會產生光。作者解釋說:「綠色增強納米燈籠(GeNL)是一種發光融合蛋白,由熒光素酶NanoLuc和熒光蛋白mNeongreen組成。在其發光受質呋喃嗪向呋喃醯胺的酶促轉化過程中,能量以光的形式發射......GeNL與呋喃嗪的酶反應取決於O2,生物發光訊號的強度與O的可用性呈線性相依2當 O2是酶促反應中的限速因子。
 這些插圖描繪了大腦血管內的毛細血管網絡。左圖顯示了富氧血液,呈紅色,透過毛細血管流入藍色動脈。在這種流動過程中,氧氣從紅細胞中釋放並被腦組織吸收,這對於產生能量以維持神經元活動至關重要。在左側,影像顯示了靜止小鼠大腦中的氧合水平。我們觀察到,與活躍的小鼠相比,休息的小鼠表現出更多的缺氧袋 - 低氧合區域 - 如左側所示。總之,身體活動似乎可以減少大腦中缺氧袋的發生,從而減輕大腦的缺氧負擔。(薛丹、費利克斯·貝因利希)像許多重要的科學發現一樣,使用這個過程來對大腦中的氧氣進行成像是偶然發現的。第一作者Felix Beinlich博士是哥本哈根大學CTN的助理教授,他最初打算使用發光蛋白來測量大腦中的鈣活性。很明顯,蛋白質的生產存在錯誤,導致研究延遲了數月之久。
這些插圖描繪了大腦血管內的毛細血管網絡。左圖顯示了富氧血液,呈紅色,透過毛細血管流入藍色動脈。在這種流動過程中,氧氣從紅細胞中釋放並被腦組織吸收,這對於產生能量以維持神經元活動至關重要。在左側,影像顯示了靜止小鼠大腦中的氧合水平。我們觀察到,與活躍的小鼠相比,休息的小鼠表現出更多的缺氧袋 - 低氧合區域 - 如左側所示。總之,身體活動似乎可以減少大腦中缺氧袋的發生,從而減輕大腦的缺氧負擔。(薛丹、費利克斯·貝因利希)像許多重要的科學發現一樣,使用這個過程來對大腦中的氧氣進行成像是偶然發現的。第一作者Felix Beinlich博士是哥本哈根大學CTN的助理教授,他最初打算使用發光蛋白來測量大腦中的鈣活性。很明顯,蛋白質的生產存在錯誤,導致研究延遲了數月之久。
在等待制造商的新批次時,Beinlich決定繼續進行實驗,以測試和最佳化監控系統。該病毒用於向星形膠質細胞傳遞產生酶的指令,星形膠質細胞是大腦中維持神經元健康和訊號傳導功能的無處不在的支持細胞,並且透過開顱手術將呋喃嗪受質註射到大腦中。
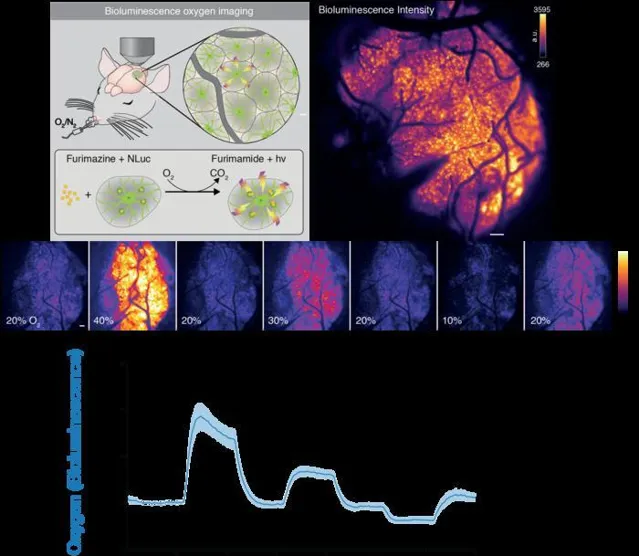
記錄揭示了由波動的生物發光強度(BLI)確定的活動,研究人員懷疑,後來證實了這一點,反映了氧氣的存在和濃度。「在這種情況下,化學反應是氧依賴性的,所以當有酶、受質和氧氣時,系統開始發光,」Beinlich說。作者進一步指出,「改變 O2濃度從 20% 增加到 40% 使 BLI 增加 ~200%,而 O 降低2吸入空氣中的濃度達到 10% 使 BLI 比基線降低 ~50%。
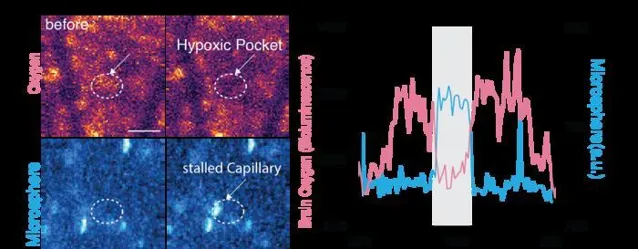
 該圖表明缺氧袋是由毛細血管停滯引起的。我們將微球引入小鼠的血液中,選擇與白細胞相當的大小,白細胞主要負責毛細血管停滯。我們監測這些微球的熒光與組織氧合測量同時進行。頂部面板使用黃色和淡紫色的配色方案來描繪氧氣水平,其中黃色表示高氧,淡紫色表示低氧。底部面板直觀地以白色表示微球。右側的折線圖說明了氧氣含量的時間變化。微球對毛細血管的閉塞,由藍線的上升表示,導致氧濃度降低。在缺氧袋期間,如灰色陰影所強調的那樣,微球熒光升高,同時組織氧合減少。[費利克斯·貝因利希]雖然現有的氧氣監測技術提供了關於大腦非常小的區域的資訊,但研究人員能夠即時觀察小鼠皮層的大部份。生物發光的強度與氧氣的濃度相對應,研究人員透過改變動物呼吸的空氣中的氧氣量來證明這一點。光強度的變化也與感覺處理相對應。例如,當老鼠的胡須受到一股空氣的刺激時,研究人員可以看到大腦的相應區域亮了起來。
該圖表明缺氧袋是由毛細血管停滯引起的。我們將微球引入小鼠的血液中,選擇與白細胞相當的大小,白細胞主要負責毛細血管停滯。我們監測這些微球的熒光與組織氧合測量同時進行。頂部面板使用黃色和淡紫色的配色方案來描繪氧氣水平,其中黃色表示高氧,淡紫色表示低氧。底部面板直觀地以白色表示微球。右側的折線圖說明了氧氣含量的時間變化。微球對毛細血管的閉塞,由藍線的上升表示,導致氧濃度降低。在缺氧袋期間,如灰色陰影所強調的那樣,微球熒光升高,同時組織氧合減少。[費利克斯·貝因利希]雖然現有的氧氣監測技術提供了關於大腦非常小的區域的資訊,但研究人員能夠即時觀察小鼠皮層的大部份。生物發光的強度與氧氣的濃度相對應,研究人員透過改變動物呼吸的空氣中的氧氣量來證明這一點。光強度的變化也與感覺處理相對應。例如,當老鼠的胡須受到一股空氣的刺激時,研究人員可以看到大腦的相應區域亮了起來。
沒有氧氣,大腦就無法長期生存,中風或心臟病發作後迅速發生的神經損傷證明了這一概念。但是,當大腦的極小部份在短時間內被剝奪氧氣時會發生什麽?直到Nedergaard實驗室的團隊開始仔細研究新的錄音,研究人員才提出這個問題。在監測小鼠時,研究人員觀察到大腦的特定微小區域會變暗,有時會持續幾分鐘,這意味著氧氣供應被切斷。 「BLI的連續成像顯示 PO 2在靜息條件下具有高度動態性,表現出 局部瞬 態下降2.這些局部缺氧事件在空間上受到限制,持續數秒至數分鐘,並且通常在相對組織 P O 中表現出急劇的開移和偏移2."
 該圖表明,改變小鼠吸入的空氣中的氧氣濃度會影響腦組織內生物傳感器的生物發光強度。具體來說,生物發光強度的增加表明大腦中氧濃度的增加。吸入空氣中的氧氣濃度每隔 60 秒改變一次。(薛丹、費利克斯·貝因利希)氧氣透過龐大的動脈網絡和滲透腦組織的較小毛細血管或微血管在整個大腦中迴圈。透過一系列實驗,研究人員能夠確定由於毛細血管停滯而導致氧氣被拒絕,當白細胞暫時阻塞微血管並阻止攜帶氧氣的紅細胞透過時,就會發生這種情況。這些區域被研究人員命名為「缺氧口袋」,與動物活躍時相比,在休息狀態下的小鼠大腦中更為普遍。「增加或阻斷毛細血管流動的操作表明,微迴圈的局部中斷是導致缺氧袋發生的原因,」該團隊還指出。
該圖表明,改變小鼠吸入的空氣中的氧氣濃度會影響腦組織內生物傳感器的生物發光強度。具體來說,生物發光強度的增加表明大腦中氧濃度的增加。吸入空氣中的氧氣濃度每隔 60 秒改變一次。(薛丹、費利克斯·貝因利希)氧氣透過龐大的動脈網絡和滲透腦組織的較小毛細血管或微血管在整個大腦中迴圈。透過一系列實驗,研究人員能夠確定由於毛細血管停滯而導致氧氣被拒絕,當白細胞暫時阻塞微血管並阻止攜帶氧氣的紅細胞透過時,就會發生這種情況。這些區域被研究人員命名為「缺氧口袋」,與動物活躍時相比,在休息狀態下的小鼠大腦中更為普遍。「增加或阻斷毛細血管流動的操作表明,微迴圈的局部中斷是導致缺氧袋發生的原因,」該團隊還指出。
毛細血管停滯被認為會隨著年齡的增長而增加,並且已在阿爾茨海默病模型中觀察到。「在阿爾茨海默病模型中觀察到毛細血管停滯增加,引發了關於毛細血管停滯的長期影響及其在長期神經元活力中的潛在作用的問題,」科學家們指出。「缺氧誘導的缺氧誘導因子1a(HIF1a)表達增加透過破壞突觸生理學和空間記憶來損害可塑性,」
「現在,研究與大腦缺氧相關的一系列疾病的大門是敞開的,包括阿爾茨海默氏癥、血管性癡呆和長期COVID,以及久坐不動的生活方式、衰老、高血壓和其他因素如何導致這些疾病,」Nedergaard說。「它還提供了一種工具來測試不同的藥物和運動類別,以改善血管健康並減緩癡呆之路。
作者進一步得出結論,「我們的研究預測,缺乏身體活動對組織 P O有直接影響2透過有利於毛細血管閉塞和增加缺氧袋的數量。相反,簡單地增加感覺輸入或運動會迅速抑制缺氧袋的發生,也特許以解釋久坐不動的生活方式與癡呆風險增加之間的聯系。











