近日,上海交通大學王鵬飛教授和團隊,設計一種無需預擴增的新型 DNAzyme 傳感器,並將其並命名為 SPOT。

圖 | 王鵬飛(來源:王鵬飛)
對於以 miRNA 和病毒 RNA 為代表的多種臨床意義核酸標記物,本次傳感器均具備檢測能力,並能實作快速、便捷的臨床分子診斷套用。
透過針對血清 miRNA 進行敏感和特異的檢測,進而可以用於乳癌、胃癌和前列腺癌等多種癌癥的分子診斷。
此外,SPOT 能從臨床拭子中靈敏準確地檢測 SARS-CoV-2 RNA。同時,SPOT 可以與側流層析技術聯合,實作對於核酸靶標的即時(POCT,point-of-care testing)檢測。
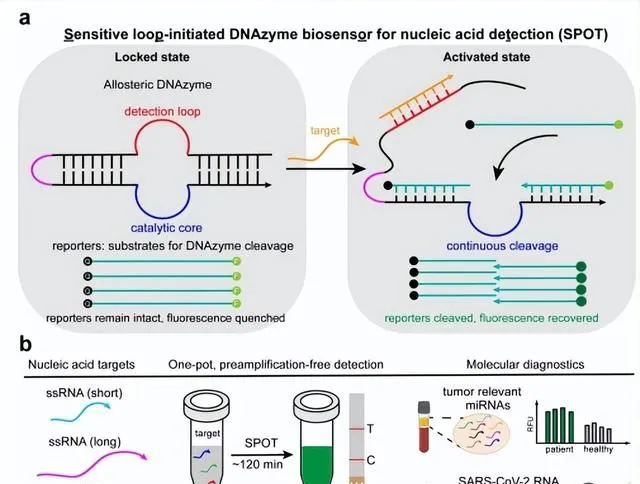
鑒於 SPOT 完全由合成 DNA 分子構建,避免了對於昂貴蛋白質酶的需求,具備較好的成本優勢。
實驗顯示,一次 SPOT 測定的材料成本,大約低至 0.02 美元,明顯低於已有的檢測體系。
與現有基於 DNA 酶、或基於 CRISPR 的核酸靶標測定相比,這種靈敏且特異的分析效能、一步法的操作方案、低成本的優勢、以及和 POCT 能力的結合,讓 SPOT 能夠成為一種更好的測定方法。
未來在檢驗醫學領域,該團隊希望利用 SPOT 體系針對迴圈體內核酸進行檢測,實作多類別疾病的靈敏特異分子診斷,從而為疾病的早期診斷和精準治療提供新的可能。
進一步地,他們也希望基於核酸適體的結合,能夠進行小分子與蛋白的檢測,擴充套件 SPOT 系統在多方面的臨床診斷套用。
此前,在體內遞送治療方面,傳統的 DNAzyme 不具備可編程的靶向性。而該團隊設計的新型 DNAzyme 體系可以快速設計和實作可編程的靶向目標鏈,並透過切割來達到治療目標。
總的來說,這一創新有望為疾病治療提供更精準、更有效的手段,為基因治療和精準醫學的發展帶來重要推動。
那麽,本次成果的研發必要性是什麽?它彌補了已有測量工具的哪些不足?
據介紹,生物體液(血液、尿液、汗液等)中存在的核酸分子,是對包括癌癥和病毒感染等重大疾病進行分子診斷的一類關鍵生物標誌物。
然而,核酸標誌物存在低豐度、高度動態、高異質性、背景幹擾大等特點,其臨床檢測面臨著測不出、測不準、測不全、測不了、測不起等挑戰。
因此,迫切需要開發超靈敏、高特異、通量高、便捷經濟的核酸生物標誌物檢測分析方法。
DNAzymes 是一類體外篩選的合成 DNA 分子,具有類似酶的催化活性,例如裂解核酸磷酸二酯鍵。
典型的裂解核酸 DNAzyme,由具有催化能力的催化核心、以及用於透過序列互補性辨識受質的兩條臂組成。
因此,當前許多 DNAzyme 已經廣泛用於體外和體內的金屬離子檢測,因為它們的催化活性高度依賴於金屬離子。
然而,具有小分子、蛋白質或核酸檢測能力的 DNAzyme 鮮有報道,導致這些目標很難被檢測到。
受自然酶和核酸酶的啟發,透過實施異構模組(如 aptamer、toehold)來設計異構的 DNAzyme 生物傳感器,可以透過小分子、蛋白質、核酸或細菌等,調節因子介導其催化活性。
傳統的異構 DNAzyme 生物傳感器通常被設計成多組分分子復合體,透過具有 toehold 的抑制鏈,來抑制並釋放 DNAzyme。
以及透過在靶結合後分裂並恢復催化核心,或透過靶誘導的 DNAzyme-受質-靶標復合物的穩定,來實作對於核酸靶的直接檢測。
然而,這些生物傳感系統對於定向核酸的直接檢測,通常表現出皮摩爾至納摩爾的敏感性,因此無法探測臨床樣本中的 miRNA 或病毒 RNA 標誌物。
而許多 miRNA 被視為是多種癌癥的潛在生物標誌物,然而由於缺乏癌癥診斷的敏感性和特異性,很少有 miRNA 被證明在臨床上有用。
王鵬飛認為,這種多組分設計可能會對其檢測能力產生負面影響。
由於一些原因比如化學計量的不完善、動力學分子陷阱、催化活性受損、以及訊號泄漏的風險增加,會導致低豐度目標更加難以被測量。
而該課題組的主要研究興趣是:開發簡單、快捷、靈敏的新型疾病分子診斷方法。
透過調研,該團隊發現體液中的迴圈核酸已經成為多種疾病的重要液體活檢生物標誌物。
由於這些核酸生物標誌物在生物標本中的高度動態、異質性和低豐度,導致其臨床檢測面臨著巨大挑戰。
傳統的聚合酶鏈式反應(PCR,Polymerase Chain Reaction)技術需要嚴格的樣品處理、昂貴儀器和專業操作。
而新型等溫擴增方法,比如重組酶聚合酶擴增(RPA,Recombinase Polymerase Amplification)、環介導等溫擴增(LAMP,Loop-mediated isothermal amplification)等則能簡化操作過程。
而盡管 CRISPR 結合等溫擴增技術,能夠顯示出較高的靈敏度和便捷性,但是存在非特異性擴增、連續操作步驟和對昂貴易損酶的需求等缺陷,限制了臨床上的套用。
透過對以上這些因素的思考、並結合課題組自身優勢,他們定下了本次課題。
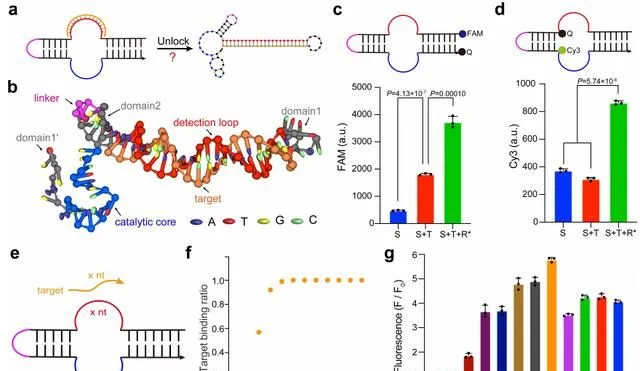
透過理論模擬與設計,他們設計出了這種新型 DNAzyme 傳感器 SPOT。為了明確 SPOT 的機制並最佳化實驗參數,課題組研究了具體的啟用方式、以及可套用的核酸靶標長度。
由於 DNAzyme 傳感器的自身特性,最初他們設計的 DNAzyme 傳感器訊號泄漏非常嚴重,無論如何最佳化實驗條件,都無法達到穩定、高靈敏的檢測目的。
透過大量的文獻調研,以及學習和理解此前 DNAzyme 傳感器的設計原理,再結合組內討論他們認為:自封鎖核酸鏈的設計,或特許以解決訊號泄漏的問題。
後來,透過一系列的實驗,訊號泄漏問題已經被解決。但是,DNA 酶傳感器卻無法被啟用。
於是,他們進一步最佳化參數,透過縮短結合臂的長度,最後成功構建了 DNAzyme 傳感器。
透過此,他們構造了一個單鏈、自釘選的單分子系統,並將這種傳感系統命名為 SPOT(用於核酸檢測的靈敏的環啟動 DNAzyme 生物傳感器)。
同時,他們進一步將 SPOT 與試紙條結合,為 SPOT 實作 POCT 檢測奠定了基礎。
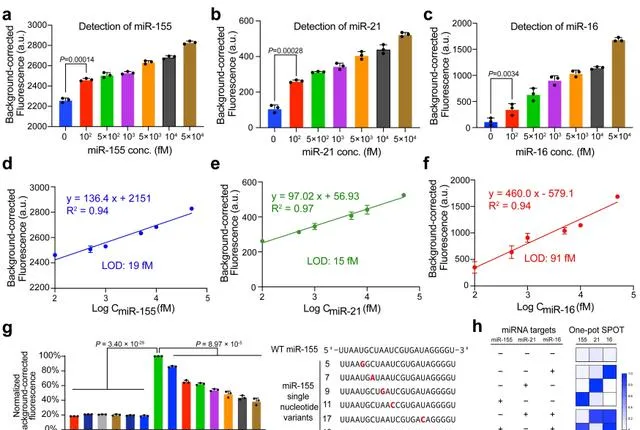
經過全面最佳化和 SPOT 檢測,在單管、一步、無預擴增和等溫檢測的前提下,實作了對 miR-21 的 15fM、對病毒 RNA 的 1.9aM 的強大檢測靈敏度,以及對於核酸靶標的檢測特異性(區分變異體)。
最終,相關論文以【一種用於核酸敏感檢測的可編程 DNAzyme】(A Programmable DNAzyme for the Sensitive Detection of Nucleic Acids)為題發在 Angewandte Chemie International Edition [1]。
史辰致是第一作者,王鵬飛擔任通訊作者。

圖 | 相關論文(來源:Angewandte Chemie International Edition)
不過,目前只有少量臨床樣本在 SPOT 上進行測試。未來,課題組將對更多患者進行臨床研究,以便全面評估 SPOT 測定的可靠性。
同時,由於本次研究采用了無前置放大器的方案,因此 SPOT 還不夠靈敏,無法在肉眼可見的測試條上,產生明顯可區分的讀數。
因此,該團隊打算進一步提高 SPOT 的靈敏度,或與基於等離子體/熒光的便攜式視覺化器材結合,以便讓 SPOT 的 POCT 能力能被用於實際套用。
未來,在臨床套用層面,他們希望能夠建立多中心、大規模臨床佇列,對 SPOT 體系的疾病診斷效能進行更大範圍的論證。
在技術改進層面,該團隊計劃拓展 SPOT 的套用範圍。除了核酸檢測外,他們也希望透過引入核酸適體,來實作對於小分子和蛋白標誌物的檢測。
參考資料:
1.Shi, C., Yang, D., Ma, X., Pan, L., Shao, Y., Arya, G., ... & Wang, P. (2024). A Programmable DNAzyme for the Sensitive Detection of Nucleic Acids. Angewandte Chemie International Edition , e202320179.
營運/排版:何晨龍











