*仅供医学专业人士阅读参考


在前几年的狂飙突进之后,再看到「免疫治疗取得成功」这几个字,奇点糕总会感觉这只像是「片头提示」,因为治疗大多数晚期实体瘤时,免疫治疗乃至免疫联合治疗能惠及的患者还是少数,科学家和临床工作者们接下来就要从各种角度,想方设法给免疫治疗加Buff。
就拿奇点糕最熟悉、关注也最多的肝细胞癌(HCC)免疫治疗来说,虽然多种免疫联合治疗方案都取得了晚期一线治疗的成功,但客观缓解率(ORR)普遍都不到30%[1],意味着近七成的患者治疗获益有限,这样的现状显然得改变,增效免疫治疗就成了热门课题。
近日在 Journal for ImmunoTherapy of Cancer 期刊上,复旦大学基础医学院吕雷团队与温州医科大学附属舟山医院马海洁团队共同发表的最新研究成果,就揭示了增效HCC免疫治疗的新策略:抑制细胞周期蛋白依赖性激酶5(CDK5),可减少HCC细胞中自噬介导的PD-L1降解,上调PD-L1表达水平,从而与PD-1/L1抑制剂形成合力,改善治疗效果 [2]。

论文首页截图
癌细胞表面有多少PD-L1表达,对PD-1/L1抑制剂的疗效影响颇大,因此近年来的许多研究都在探寻影响PD-L1表达水平的因素,翻译后修饰(post-translational modifications,PTMs) 就是机制研究的热点之一,糖基化、泛素化、磷酸化等修饰都可能影响PD-L1的稳定性及其与PD-1的相互作用,治疗干预策略也可以由此入手。
例如2018年登上【自然】的一项研究就显示,CDK4可通过调控泛素化修饰,影响PD-L1的稳定性,这为CDK4/6抑制剂与免疫治疗的协同奠定了理论基础[4],而此次研究聚焦的CDK5也是CDK家族成员,它已被证实可间接调控非小细胞肺癌(NSCLC)等癌症的PD-L1表达水平[5],在HCC中情况又如何呢?
研究者们首先使HCC细胞等多种细胞过表达CDK5,细胞的PD-L1表达水平就「应声而降、一落千丈」,而且这种改变是在蛋白层面而非mRNA层面发生的,说明CDK5的调控确实发生在翻译后修饰阶段。研究者们又标记PD-L1并对其半衰期进行分析,发现溶酶体介导的降解很可能参与了CDK5导致的PD-L1蛋白质表达下调。
进一步实验揭示了CDK5上调PD-L1降解的全过程:作为一种丝氨酸/苏氨酸激酶, CDK5可直接与PD-L1蛋白的胞内段结合,并介导T290位点的磷酸化 ,而这会 使PD-L1更容易与热休克蛋白70(HSC70)结合 ,后者在溶酶体经分子伴侣介导的自噬(CMA)过程中起到关键调控作用, HSC70与PD-L1结合得越好,作为底物的PD-L1就更容易被降解 。
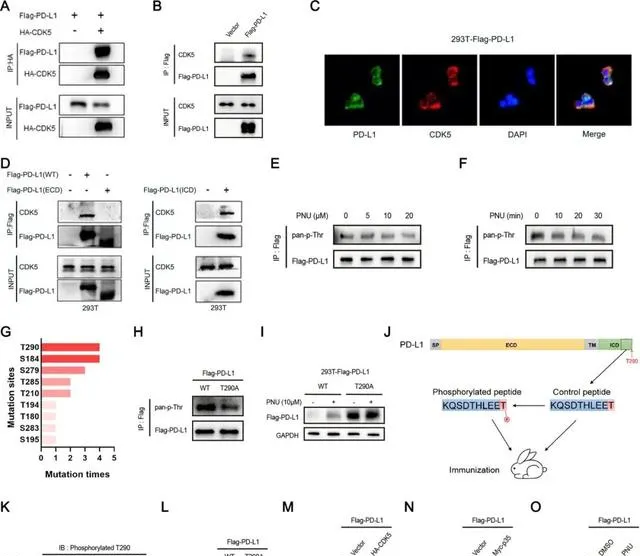
CDK5可通过磷酸化T290位点,上调PD-L1在溶酶体中的降解
CDK5的过表达和激活会导致PD-L1降解,反过来抑制CDK5会使PD-L1的表达上调,那么理论上说,CDK5抑制剂就与PD-1/L1抑制剂存在协同增效了。小鼠实验就显示, CDK5抑制剂与PD-1抑制剂联合治疗,可使8只荷瘤小鼠中的7只实现完全缓解,肿瘤中浸润的各类淋巴细胞(TILs)大幅增多,小鼠总生存期(OS)也较单药处理组显著延长 。
CDK5抑制剂与PD-1/L1抑制剂可实现协同增效
最后,研究者们分析了88例HCC患者的肿瘤样本,证实T290位点磷酸化的PD-L1(p-T290-PD-L1)表达水平与CDK5表达水平正相关,但与全部PD-L1表达水平负相关,且p-T290-PD-L1低表达肿瘤的免疫抑制性更强(体现为肿瘤中浸润的CD8 + T细胞更少) ,也与患者预后较差相关,提示p-T290-PD-L1有作为生物标志物应用的潜力。

一图总结论文机制层面发现
至于CDK5抑制剂与PD-1/L1抑制剂联合,能否成为HCC全新的免疫联合治疗策略,就有待未来临床研究来评估了,既然目前还没有CDK5抑制剂获批上市,那在研药物不妨以HCC作为关键研究的目标,说不定就能给患者雪中送炭啊。
参考文献:
[1]Rimassa L, Finn R S, Sangro B. Combination immunotherapy for hepatocellular carcinoma[J]. Journal of Hepatology, 2023, 79(2): 506-515.
[2]Zhang R, Wang J, Du Y, et al. CDK5 destabilizes PD-L1 via chaperon-mediated autophagy to control cancer immune surveillance in hepatocellular carcinoma[J]. Journal for ImmunoTherapy of Cancer, 2023, 11(11): e007529.
[3]Zhou S, Zhu J, Xu J, et al. Anti‐tumour potential of PD‐L1/PD‐1 post‐translational modifications[J]. Immunology, 2022, 167(4): 471-481.
[4]Zhang J, Bu X, Wang H, et al. Cyclin D–CDK4 kinase destabilizes PD-L1 via cullin 3–SPOP to control cancer immune surveillance[J]. Nature, 2018, 553(7686): 91-95.
[5]De S, Holvey-Bates E G, Mahen K, et al. The ubiquitin E3 ligase FBXO22 degrades PD-L1 and sensitizes cancer cells to DNA damage[J]. Proceedings of the National Academy of Sciences, 2021, 118(47): e2112674118.

本文作者丨谭硕











