来 源 :吴恩慧,章建华,张 琳,李清林,王 玲,尹 华.基于UPLC-Q-TOF-MS代谢组学技术研究淫羊藿-川芎对骨关节炎大鼠的调控作用 [J]. 中草药, 2023, 54(22): 7445-7453.
骨关节炎(osteoarthritis,OA)是一种以关节软骨的退行性病变和继发性骨质增生为主要病变的慢性关节疾病,以关节疼痛、滑膜炎症和活动受限为主要表现[1]。目前化学药治疗以缓解疼痛、抗炎或改善功能状态为主,但不良反应明显,不宜长期应用,因此尚缺乏切实有效的治疗手段和药物[2]。中医临床多以「补肾活血」为治疗准则[3],常以出自【太平圣惠方】的补肾活血药对淫羊藿-川芎配伍使用。淫羊藿补肾壮阳而治肾虚之根本,入肝肾祛风湿强筋骨;川芎活血祛瘀、祛风止痛治疗血瘀气滞[4-5]。
OA疾病发展过程及其治疗与代谢密切相关,代谢组学的研究可用于发现疾病的发病机制及探究药对干预下的调控机制[6-8]。研究表明,在OA发展过程中,软骨细胞代谢发生改变,基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)参与软骨的降解,滑膜细胞和软骨细胞局部合成的促炎细胞因子白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)造成关节软骨持续损伤[9-11]。药理研究表明,淫羊藿可调节软骨细胞代谢,促进软骨基质合成和细胞增殖[12-13]。川芎的有效成分可抑制炎症因子IL-1β、TNF-α、MMP-13的表达[14-15]。
淫羊藿-川芎对OA的作用机制尚不清楚,因此本研究基于超高效液相色谱-四极杆-飞行时间质谱联用仪(ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF-MS)的代谢组学方法考察淫羊藿-川芎配伍及其单药治疗OA的内源性代谢产物变化及代谢轮廓,明确其发挥药效的代谢调控通路。
病理结果
OA模型大鼠关节软骨组织病理学经时评价
如图1所示,正常组及假手术组关节面光滑平整,颜色红润鲜艳,SO着色均匀,软骨细胞排列整齐,四层结构及潮线清晰可见。造模第2周模型组大鼠关节软骨较正常组无明显变化,仅在软骨层表面有较小、浅的裂隙;第4周关节软骨层变薄,表面粗糙,局部软骨出现片状脱落,部分软骨基质不着色;第6周关节软骨层严重破坏,各层软骨细胞簇集生长,排列紊乱;第8周病变加剧,可见软骨细胞坏死,潮线更加不规则或完全消失,甚至可见软骨下骨暴露。提示第6周OA模型建立成功。
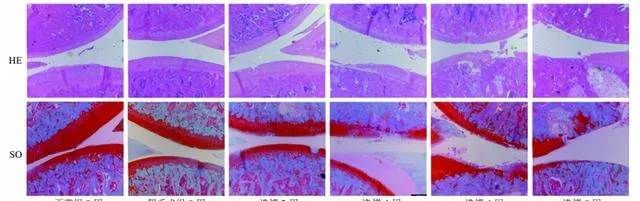
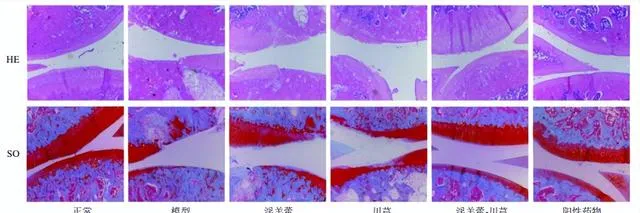
淫羊藿-川芎对OA大鼠膝关节组织病理学的影响
如图2所示,正常组关节面光滑平整,颜色红润,软骨细胞排列整齐,四层结构及潮线清晰可见,SO着色均匀,颜色鲜艳。模型组关节软骨层明显变薄,软骨部分脱落,软骨细胞簇集,排列紊乱,潮线多不完整或完全消失,SO着色重度减弱,可见坏死崩解细胞,甚至可见软骨下骨质外露。各给药组软骨细胞排列有序,软骨细胞聚集生长现象逐渐消失,软骨层逐渐恢复。
淫羊藿-川芎组和阳性药物组关节软骨层光滑,无明显软骨细胞聚集,SO着色均匀,但阳性药物组软骨细胞内可见大量脂肪滴。淫羊藿组软骨层表面有轻微裂缝,未见明显软骨脱落,软骨细胞排列较为整齐,但存在细胞聚集;川芎组软骨层薄且脱落明显,淫羊藿组和川芎组均存在失染现象,但淫羊藿组较川芎组软骨层厚,软骨细胞簇集程度较弱。说明淫羊藿、川芎及其配伍、阳性药物均对OA有治疗作用。淫羊藿-川芎配伍治疗效果与阳性药物相似,较单用更佳。
MMP-13结果
OA模型大鼠血浆中MMP-13水平经时评价
如表1所示,与正常组比较,假手术组MMP-13水平无明显差异,模型组造模2周后MMP-13水平显著升高( P <0.05、0.01)。
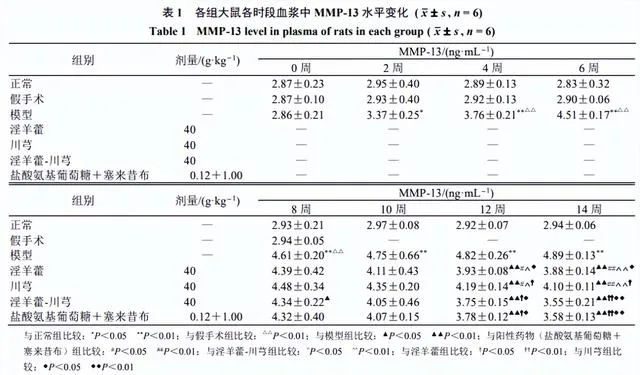
单药及配伍对OA大鼠血浆中MMP-13水平的影响
各给药组于第12、14周的MMP-13水平较同时期模型组有显著性差异( P <0.01)。淫羊藿-川芎组和阳性药物组血浆中MMP-13水平显著低于淫羊藿组和川芎组( P <0.05、0.01)。说明阳性药物组、淫羊藿、川芎与淫羊藿-川芎均有治疗OA的作用,且配伍使用效果较好。
代谢组学分析
OA大鼠模型代谢组学分析
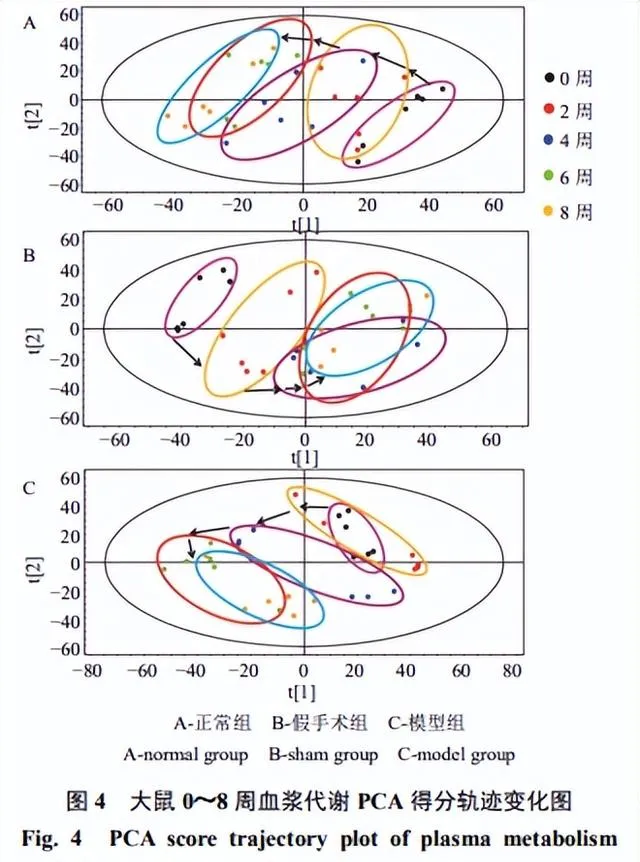
各组大鼠0~8周血浆代谢动态反映了OA的发展,如图3所示,第0、2周,3组血浆样本代谢无明显变化,第4、6、8周,3组样本均呈现分离趋势,假手术组的趋势更接近模型组。正常组大鼠未进行任何手术,6周的代谢变化只反映了大鼠正常衰老的情况;而假手术组模仿OA模型组大鼠实施了手术,体现了创伤对机体内源性成分的影响,其代谢变化由大鼠正常衰老和手术创伤共同作用产生。因此,在进行OA代谢组学研究时,以假手术组作为空白对照组更为合理。
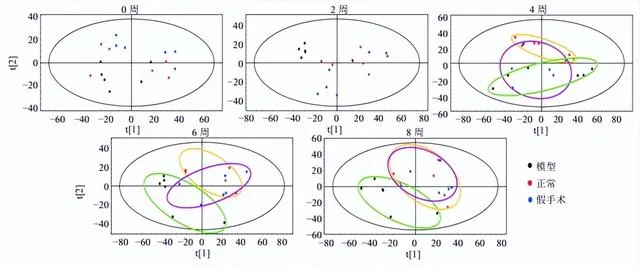
如图4所示,正常组呈现一定的代谢变化趋势,可能是大鼠正常衰老的生理变化。假手术组较正常大鼠0~2周分离趋势较明显,4~8周变化趋于缓和,可能与手术创伤及机体自身修复有关。模型组造模前后样本分离明显,随着时间的推移,第4~8周呈现有规律的分离,OA大鼠内源性代谢产物较正常组有明显变化。第4~6周变化最明显,第6~8周趋于稳定,说明第6周OA模型建立成功。
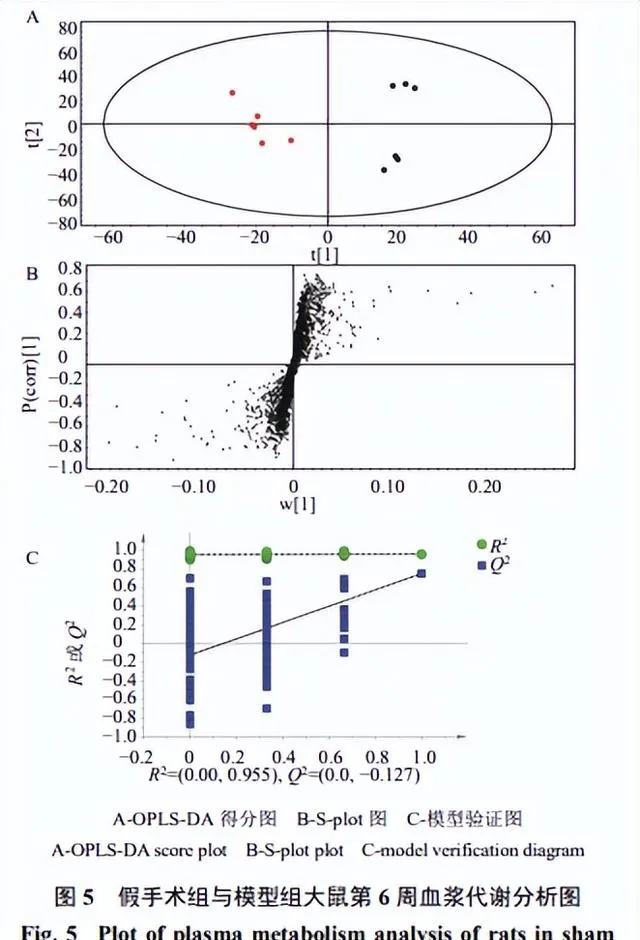
为了使组间差异最大化,消除组内变异对分类的负面影响,建立模型组和假手术组的OPLS-DA模型(图5),模型组和假手术组能明显分开,两者在代谢产物方面具有明显差异。在200次迭代中应用排列检验,说明没有过拟合。
给药组大鼠代谢组学分析
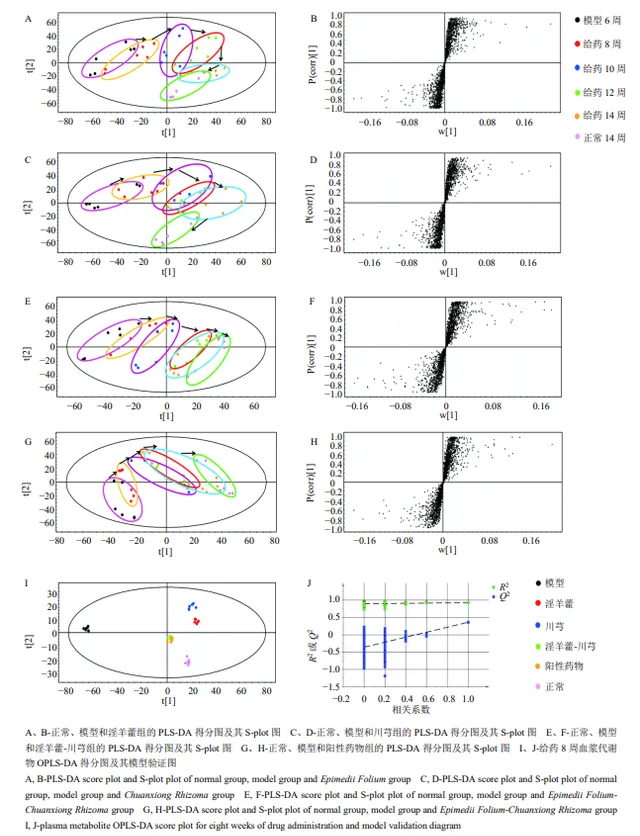
如图6-A~H所示,各给药组于第10~14周与模型组达到分离,并逐渐向正常组靠拢,在第14周趋势最为明显。说明各给药组均可调控其向正常状态转变,其中淫羊藿-川芎组和阳性药物组调控作用明显优于单药。各给药组OPLS-DA图(图6-I、J)显示,淫羊藿-川芎和阳性药物组疗效优于淫羊藿和川芎单药,进行了模型验证,显示 Q 2截距小于0,未过拟合,模型可靠,初步阐明「补肾活血」法治疗OA的科学性。
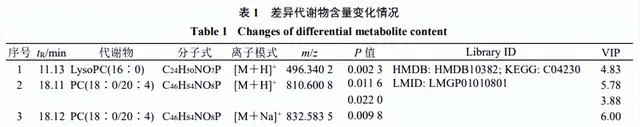
血浆潜在生物标志物的筛选
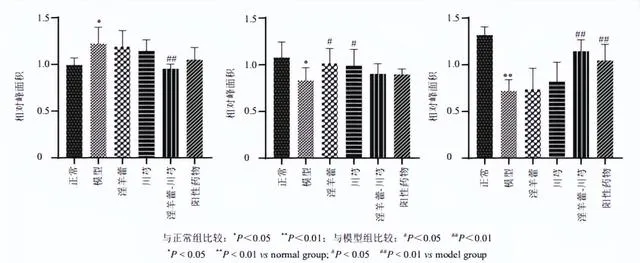
结合OPLS-DA模型的VIP值及 P <0.05筛选出OA模型中69种差异表达代谢物。通过建立第8周和第14周各给药组样本的S-plot图,从淫羊藿组、川芎组、淫羊藿-川芎组和阳性药物组中筛选出16种差异表达代谢物,鉴定出2个潜在的生物标志物(表1和图7)。Lyso PC(16∶0)水平下调,该生物标志物仅受淫羊藿-川芎的调控,提示淫羊藿与川芎联合用药可能增强对OA代谢物的调控。
血浆的代谢通路分析
潜在的生物标志物属于甘油磷脂,如LysoPC、PC,与磷脂代谢通路相关,代谢途径可能为OA的发病机制及淫羊藿-川芎对OA大鼠作用机制提供依据。
讨论
本研究采用UPLC-Q-TOF-MS技术经时评价OA造模过程中血浆内源性代谢物和MMP-13水平的动态变化,直观揭示了OA大鼠模型在代谢层面的发病轨迹,有助于为OA的早期诊断提供依据。研究了淫羊藿-川芎配伍对OA大鼠代谢的调控作用,给药后各组代谢轮廓变化及回调,其结果与组织病理学和MMP-13评价的药效作用一致,证明了其配伍治疗OA的合理性。初步获得2个生物标志物,分别为LysoPC(16∶0)和PC(18∶0/20∶4),与磷脂代谢通路相关。
课题组前期考察淫羊藿-川芎不同配比(1∶1、1∶2、2∶1)对OA大鼠的药效作用,病理组织学(HE、SO染色),MMP-13、IL-1β检测结果表明淫羊藿、川芎以1:1配伍使对OA大鼠的药效作用最佳。故选择淫羊藿-川芎(1∶1)研究其配伍机制。
经时评价OA造模过程中,第6周OA模型建立,第8周OA病变进一步加重。一般药物干预主要对早期和中期OA有效。为体现OA早期诊断、早期治疗的理念,本研究选择造模后6周进行药物干预研究。随着造模时间的延长,模型组大鼠血浆中MMP-13表达水平逐步升高,提示可将MMP-13的表达水平作为评价OA模型建立的一个评价指标。给药后,各给药组血浆中MMP-13水平随给药时间的延长而逐步降低,提示MMP-13水平可用于疗效评价。
本研究初步获得2个生物标志物,分别为LysoPC(16:0)和PC(18∶0/20∶4),LysoPCs和PCs是脂质双分子层的组成部分,可以调节跨膜信号传导[18]。OA与磷脂的结构和浓度的变化密切相关。PCs的缺乏,特别是含有长链脂肪酸的不饱和PCs,可能会增加摩擦并导致关节软骨损伤[19]。PCs可通过磷脂酶A2(PLA2)水解生成LysoPCs,而OA软骨细胞中PLA2的高表达可促进IL-1β、TNF等炎性因子的表达[20-21]。
Zhang等[22]研究发现,LysoPCs与PCs的比率可用于预测OA,与正常人相比,OA患者血浆中LysoPCs水平较高,PCs水平较低。氧化应激反应也可导致OA,当活性氧存在时,可以促使PCs转化为LysoPCs[23]。OA软骨细胞、滑膜成纤维细胞和脂肪细胞均可产生造成机械、生化刺激的活性氧和一氧化氮。中性粒细胞可以通过释放蛋白水解酶混合物以结合活性氧,导致软骨组织破坏[24-26]。
本研究从代谢组学层面初步揭示淫羊藿-川芎对OA大鼠的作用机制,证明其配伍合理性,动态监测OA进展和淫羊藿-川芎治疗情况的结果,为探索中医药治疗OA代谢组学的潜在疗效和机制提供了更有效的途径。











