*仅供医学专业人士阅读参考

2023 SABCS会议要点精彩速递!
撰文丨 Lily
第46届美国圣安东尼奥乳腺癌研讨会(SABCS)于2023年12月5日-9日召开,作为乳腺癌研究领域中规模最大、最具盛名的科学聚会之一,SABCS集结了近一年来乳腺癌领域的最新研究成果、临床实践经验、治疗进展和技术创新等内容。
开幕日,Ruth O’Regan教授以「Combination endocrine therapy following progression on first-line therapy」为题发表演讲,分享了关于 激素受体阳性(HR+)转移性乳腺癌患者的后线治疗决策观点。 医学界肿瘤频道特整理重点,以飨读者。

图1.Ruth O’Regan教授发表演讲
All about Genomics!后线治疗更需有的放矢
Ruth O’Regan教授强调,当考虑HR+转移性乳腺癌患者的二线甚至三线治疗方案时,不应忽视基因组学的重要性。HR+转移性乳腺癌涉及大量基因改变,如P53突变存在于所有乳腺癌,约40% HR+乳腺癌存在PIK3CA突变,且这两种突变往往在乳腺癌诊断时已存在,并非获得性改变。而ESR1突变则往往在经过内分泌药物后获得,ERB2和AKT1同样是获得性改变。
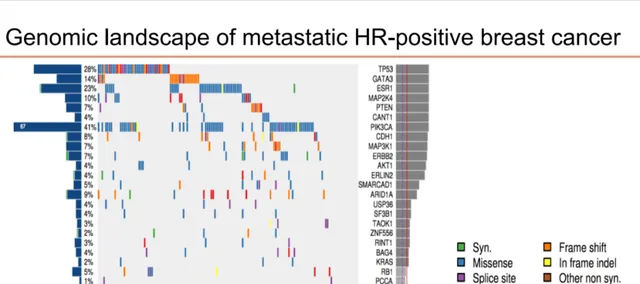
图2.HR+转移性乳腺癌基因组学特征
因此,进行基因检测并找出患者的「病因」非常重要。在确诊转移性乳腺癌时,应对转移灶活检组织行基因组学检查;疾病进展时,通过ctDNA复查基因组学变化,尤其是ESR1、ERB2、AKT1等获得性突变;必要时,可对原发组织上检测非获得性改变的基因组学特征,如PIK3CA突变等。
Ruth O’Regan教授总结到,根据是否存在基因组学改变,治疗决策主要分为两个思路:
一、未发现可治疗基因改变,此时可考虑内分泌治疗联合:
另一种CDK4/6抑制剂
mTOR抑制剂
二、针对可治疗基因改变,则可选用内分泌治疗联合:
PIK3或AKT抑制剂
HER2抑制剂
口服SERD
随后,Ruth O’Regan教授针对上述不同联合治疗方案的应用人群、研究现状以及治疗时机的选择进行了详尽分析与介绍。
CDK4/6抑制剂再挑战,治疗时机如何选择?
此前,对于CDK4/6抑制剂在HR+/HER2-晚期乳腺癌二线治疗应用,MONALEESA3、MONARCH 2、PALOMA 3研究都进行了探索。结果显示, 瑞波西利、阿贝西利、哌柏西利明显改善患者的无进展生存期(PFS)达5个月-8个月,降低疾病进展风险比例相当,约40%-60%;而总生存期(OS)的延长在7个月-10个月之间。 内分泌治疗联合CDK4/6抑制剂为患者带来显著的生存获益,但值得注意的是,MONALEESA-3的二线亚组的OS改善并未取得统计学意义。
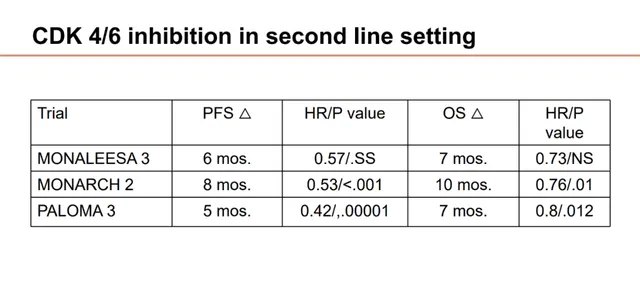 图3.MONALEESA3、MONARCH 2、PALOMA 3研究疗效数据汇总(非头对头研究,请勿直接对比)
图3.MONALEESA3、MONARCH 2、PALOMA 3研究疗效数据汇总(非头对头研究,请勿直接对比)
▌ 是否所有患者都应在一线治疗中应用CDK4/6抑制剂?CDK4/6抑制剂的使用时机该如何选择?
2023年ASCO会议上报告的SONIA研究,是一项评估CDK4/6抑制剂作为晚期HR+/HER-乳腺癌患者一线/二线治疗方案疗效对比的随机III期临床试验。共1050名转移性乳腺癌患者被分配至CDK4/6抑制剂一线治疗组和CDK4/6抑制剂二线治疗组,其中一线组患者首先接受芳香化酶抑制剂(AI)联合CDK4/6抑制剂作为一线治疗,疾病进展后接受氟维司群转为二线治疗。二线组患者首先接受AI治疗,随后接受AI联合CDK4/6抑制剂转为二线治疗,主要终点为二线治疗后的PFS2。
图4.SONIA研究设计
结果显示,CDK4/6抑制剂一线治疗或二线治疗的中位PFS在统计学上无明显差别,两组的中位PFS2分别为31.0和26.8个月(HR=0.87,0.74-1.03,p=0.1)。 与AI一线治疗后,二线应用CDK4/6抑制剂联合氟维司群相比,一线治疗使用CDK4/6抑制剂联合AI,二线使用氟维司群并没有改善PFS。
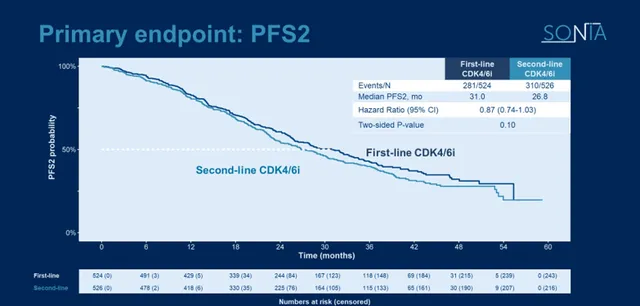
图5.SONIA研究PFS2数据
尽管如此,Ruth O’Regan教授表示:「SONIA研究仍很难撼动目前CDK4/6抑制剂在一线治疗中的地位。如何通过生物标志物更精准地筛选治疗获益人群,是值得我们进一步探索的方向。」
▌ 一线治疗后出现疾病进展,继续使用CDK4/6抑制剂的效果如何?
目前CDK4/6抑制剂联合内分泌跨线治疗仍存争议,对此,MAINTAIN研究、PACE研究与PALMIRA研究进行了探索。
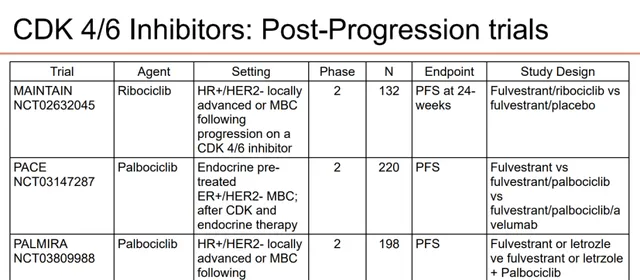
图6.MAINTAIN、PACE与PALMIRA
研究设计汇总
MAINTAIN研究 旨在评估氟维司群/依西美坦联合或不联合瑞波西利在既往接受CDK4/6抑制剂联合内分泌治疗进展的HR+/HER2-晚期乳腺癌中的疗效和安全性。结果显示,氟维司群/依西美坦+瑞波西利相比对照组能显著改善患者的中位PFS(5.29个月 vs 2.76个月,HR=0.57,0.39-0.95;P=0.006)。
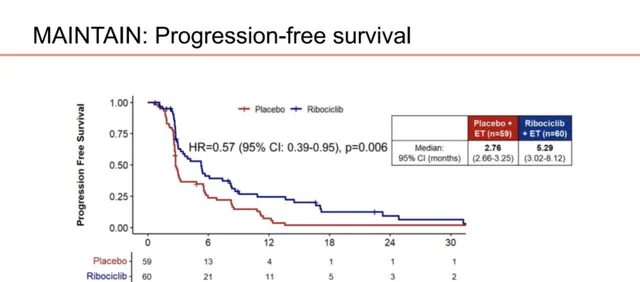
图7.MAINTAIN研究PFS数据
PACE研究 表明,针对一线治疗中接受过CDK4/6抑制剂治疗的患者,哌柏西利联合氟维司群±Avelumab相比氟维司群单药组,均未能显著改善患者的中位PFS。而在 PALMIRA研究 中,哌柏西利+氟维司群/来曲唑一线治疗经治HR+/HER2-晚期乳腺癌患者,序贯使用哌柏西利+氟维司群/来曲唑,并无显著的PFS改善。
综合以上研究,目前CDK4/6抑制剂跨线治疗策略应用于CDK4/6抑制剂经治人群的证据并不充分,并且总体获益较为有限 。
mTOR抑制剂研究进展
尽管CDK4/6抑制剂疗效良好,但患者最终仍将面临耐药问题,已有多项临床前研究和临床研究对CDK4/6抑制剂的耐药机制进行了探索,显示其分子机理非常复杂。而mTOR抑制剂(如依维莫司)通过直接且持续作用于mTOR靶点,抑制活化的mTOR以及其下游蛋白质活性,干扰癌细胞的生长、分化和代谢。
TAMRAD研究 入组既往接受AI作为辅助内分泌治疗、对AI耐药的HR+/HER2-晚期乳腺癌患者,随机接受他莫昔芬联合依维莫司或他莫昔芬单药治疗。结果提示一线治疗选择他莫昔芬联合依维莫司较单用他莫昔芬,其中位至进展时间显著延长,分别为8.6个月和4.5个月(HR=0.53,P=0.0026)。
BOLERO-2研究 则纳入了既往接受来曲唑或阿那曲唑治疗进展后绝经的ER+晚期乳腺癌患者,给予依西美坦+依维莫司或依西美坦治疗。结果显示,依西美坦+依维莫司组的PFS显著长于依西美坦组,分别为10.6个月和4.1个月(HR=0.45,P<0.0001),但两组间OS并无显著差异(31个月vs 26.6个月,HR=0.89,P=0.14)。
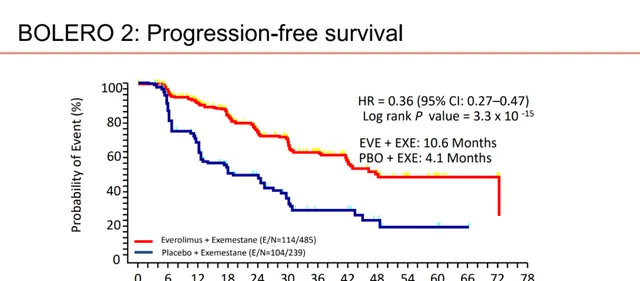
图8.BOLERO-2研究PFS数据
PrECOG0102研究 则比较了氟维司群联合依维莫司在既往AI耐药的HR+/HER2-晚期患者中的疗效。结果显示,与氟维司群单药相比,氟维司群联合依维莫司可提高近一倍的PFS获益(10.4个月vs 5.1个月)。
PIK3/AKT抑制剂研究进展
■ PIK3抑制剂
针对可治疗基因突变、变异或改变的患者,PIK3抑制治疗是重要方向。BELLE-2、BELLE-3及SANDPIPER研究分别探索了泛PI3K抑制剂Buparlisib和突变选择性PI3K抑制剂Taselisib联合氟维司群对比氟维司群单药在AI治疗后进展的乳腺癌患者中的疗效,均取得了阳性结果,然而显著毒性与未发现生物标志物限制了其应用。
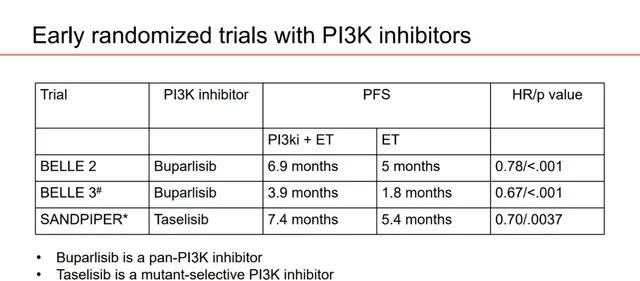
图9.BELLE-2、BELLE-3及SANDPIPER研究疗效数据汇总(非头对头研究,请勿直接对比)
而SOLAR-1研究则探索了氟维司群联合Alpelisib对比安慰剂治疗既往接受过内分泌治疗的HR+/HER2-晚期乳腺癌患者的疗效和安全性。结果显示,在PIK3CA突变患者中,Alpelisib+氟维司群与氟维司群单药治疗比较,显著延长患者的PFS(11.0个月 vs 5.7个月),疾病进展或死亡风险显著降低35%;患者中位OS延长7.9个月(39.3个月 vs 31.4个月)。
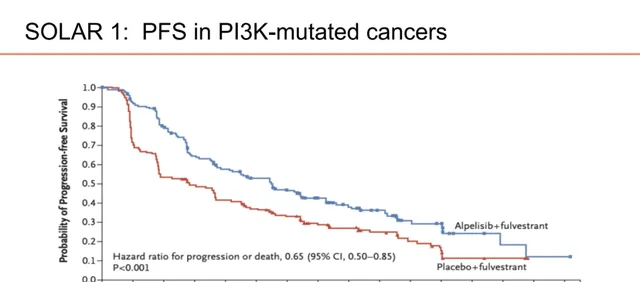
图10.SOLAR-1研究中PIK3CA突变患者的PFS数据
■ AKT抑制剂
CAPItello-291研究则旨在评估AKT抑制剂Capivasertib联合氟维司群对比安慰剂联合氟维司群治疗辅助AI期间或者治疗结束后<12个月内复发或既往AI治疗ABC期间进展的HR+/HER2-晚期乳腺癌患者的疗效和安全性。结果显示,在总体人群中,Capivasertib联合氟维司群将PFS从3.6个月显著延长至7.2个月(HR=0.60,0.51-0.71);而在AKT通路改变患者中,Capivasertib联合氟维司群组的中位PFS亦达成翻倍(7.3个月vs3.1个月,HR=0.50,0.38-0.65)。
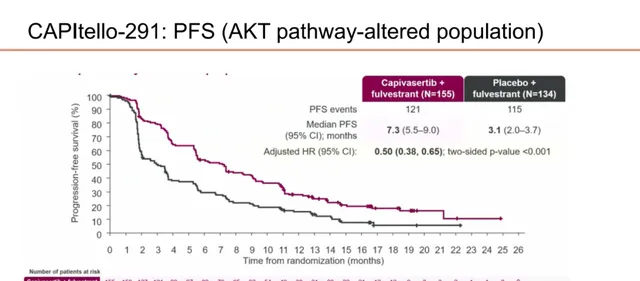
图11.CAPItello-291研究中AKT通路改变患者的PFS数据
然而其安全性亦值得重视:Capivasertib组最常见的任何级别不良事件(AE)为腹泻(两组分别为72.4%和20.0%)、恶心(34.6%和15.4%)和皮疹(38.0%和7.1%),最常见≥3级AE为腹泻、斑丘疹和皮疹,因AE导致的患者药物减量发生率为19.7%(安慰剂组为1.7%)。
口服SERD研究进展
作为新一代强效内分泌治疗选择,口服SERD已成为HR+乳腺癌领域的重要研发方向。目前多个口服SERD包括Elacestrant、Giredestrant、Camizestrant与Imlunestrant,与CDK4/6抑制剂或与PI3K/Akt/mTOR抑制剂的内分泌治疗方案临床研究都在积极推进中。
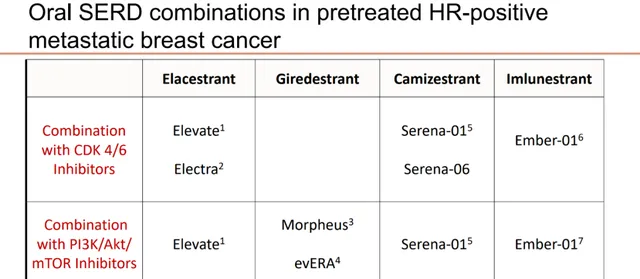
图12.口服SERD研究进度汇总
HER2抑制治疗进展
HER2突变亦是HR+转移性乳腺癌患者的可治疗突变。对此,SUMMIT研究探索了奈拉替尼单药或联合疗法在HER2突变的多种实体瘤中的疗效和安全性。
在该研究中,对于CDK4/6抑制剂经治后进展的HER2突变乳腺癌患者,奈拉替尼+氟维司群+曲妥珠单抗三药联合方案客观缓解率(ORR)为39%,包括1例完全缓解(CR)和21例部分缓解(PR),临床获益率(CBR)为54%,中位反应持续时间(DOR)为14.4个月(6.4个月-21.7个月),中位PFS为8.3个月(6.0个月-15.1个月);在氟维司群单药组或氟维司群+曲妥珠单抗组均未观察到CR或PR。
最后,Ruth O’Regan教授教授总结道: 「内分泌治疗进展后的治疗决策,具体治疗方案以及CDK4/6抑制剂的应用前提,都是基于肿瘤或ctDNA的基因组分析: 对于PIK3CA突变患者,可应用Alpelisib或capivasertib联合内分泌治疗方案; 若未发现可治疗突变,则可尝试换用CDK4/6抑制剂或依维莫司联合内分泌治疗方案。 随着ADC药物在治疗线上的不断前移,未来对于基因测序的应用或将出现相应改变。 」

责任编辑:Sheep
* "医学界"力求所发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。











