罗切斯特大学(University of Rochester)和哥本哈根大学(University of Copenhagen)的研究人员开发了一种生物发光成像技术,可以创建小鼠大脑中氧气运动的高度详细且视觉上引人注目的图像。该技术提供了一种更多地了解脑氧张力( P O2),一种动态变化但尚不清楚的脑组织中氧气输送和需求的量度。研究人员认为,这种方法可以很容易地被其他实验室复制,将使研究人员能够更精确地研究大脑中缺氧的形式,例如在中风或心脏病发作期间发生的大脑缺氧。
该团队的实验,包括监测清醒小鼠的氧气,提供了关于为什么久坐不动的生活方式可能会增加患阿尔茨海默氏症等疾病风险的见解。「这项研究表明,我们可以在大脑的广泛区域连续监测氧气浓度的变化,」位于罗切斯特大学和哥本哈根大学的转化神经医学中心(CTN)联合主任Maiken Nedergaard医学博士说。「这为我们提供了实时大脑中发生的事情的更详细的图片,使我们能够识别以前未检测到的暂时性缺氧区域,这些区域反映了可能引发神经功能缺损的血流变化。
Nedergaard及其同事在 【科学】杂志上 发表了一篇题为「小鼠大脑皮层缺氧口袋的氧气成像」的论文。
人脑消耗大量的能量,这些能量几乎完全来自一种需要氧气的新陈代谢形式。「人类大脑在休息时使用约20%的全身耗氧量,」作者写道。「氧气的输送和需求(O2)是如此精细的平衡,以至于维持组织氧合可能是所有大脑功能中最关键的。但是,尽管已知氧气的有效和及时输送对健康的大脑功能至关重要 - 「在脑血流停止后几秒钟内失去意识,」研究小组指出 - 这个过程的确切机制在很大程度上仍然是未知的。
科学家对脑组织氧张力动力学的理解( P O2)在生理条件下受到限制,主要是因为缺乏空间精确的 P O2测量技术成像,团队继续说道。「目前,组织 P O2可以通过磷光和克拉克型电极进行测量。这两种方法都不能提供足够高的时空灵敏度来检测皮质 P O2 的生理变化".
为了解决这些局限性,该团队开发了一种新技术,该技术采用了一种基因编码的生物发光氧指示蛋白,这是在萤火虫中发现的生物发光蛋白的化学表亲。这种蛋白质已被用于癌症研究,是使用一种病毒产生的,该病毒向细胞传递指令以酶的形式产生发光蛋白质。当酶遇到第二种化合物,一种称为呋喃嗪的底物时,化学反应会产生光。作者解释说:「绿色增强纳米灯笼(GeNL)是一种发光融合蛋白,由荧光素酶NanoLuc和荧光蛋白mNeongreen组成。在其发光底物呋喃嗪向呋喃酰胺的酶促转化过程中,能量以光的形式发射......GeNL与呋喃嗪的酶反应取决于O2,生物发光信号的强度与O的可用性呈线性相关2当 O2是酶促反应中的限速因子。
 这些插图描绘了大脑血管内的毛细血管网络。左图显示了富氧血液,呈红色,通过毛细血管流入蓝色动脉。在这种流动过程中,氧气从红细胞中释放并被脑组织吸收,这对于产生能量以维持神经元活动至关重要。在左侧,图像显示了静止小鼠大脑中的氧合水平。我们观察到,与活跃的小鼠相比,休息的小鼠表现出更多的缺氧袋 - 低氧合区域 - 如左侧所示。总之,身体活动似乎可以减少大脑中缺氧袋的发生,从而减轻大脑的缺氧负担。(薛丹、费利克斯·贝因利希)像许多重要的科学发现一样,使用这个过程来对大脑中的氧气进行成像是偶然发现的。第一作者Felix Beinlich博士是哥本哈根大学CTN的助理教授,他最初打算使用发光蛋白来测量大脑中的钙活性。很明显,蛋白质的生产存在错误,导致研究延迟了数月之久。
这些插图描绘了大脑血管内的毛细血管网络。左图显示了富氧血液,呈红色,通过毛细血管流入蓝色动脉。在这种流动过程中,氧气从红细胞中释放并被脑组织吸收,这对于产生能量以维持神经元活动至关重要。在左侧,图像显示了静止小鼠大脑中的氧合水平。我们观察到,与活跃的小鼠相比,休息的小鼠表现出更多的缺氧袋 - 低氧合区域 - 如左侧所示。总之,身体活动似乎可以减少大脑中缺氧袋的发生,从而减轻大脑的缺氧负担。(薛丹、费利克斯·贝因利希)像许多重要的科学发现一样,使用这个过程来对大脑中的氧气进行成像是偶然发现的。第一作者Felix Beinlich博士是哥本哈根大学CTN的助理教授,他最初打算使用发光蛋白来测量大脑中的钙活性。很明显,蛋白质的生产存在错误,导致研究延迟了数月之久。
在等待制造商的新批次时,Beinlich决定继续进行实验,以测试和优化监控系统。该病毒用于向星形胶质细胞传递产生酶的指令,星形胶质细胞是大脑中维持神经元健康和信号传导功能的无处不在的支持细胞,并且通过开颅手术将呋喃嗪底物注射到大脑中。
记录揭示了由波动的生物发光强度(BLI)确定的活动,研究人员怀疑,后来证实了这一点,反映了氧气的存在和浓度。「在这种情况下,化学反应是氧依赖性的,所以当有酶、底物和氧气时,系统开始发光,」Beinlich说。作者进一步指出,「改变 O2浓度从 20% 增加到 40% 使 BLI 增加 ~200%,而 O 降低2吸入空气中的浓度达到 10% 使 BLI 比基线降低 ~50%。
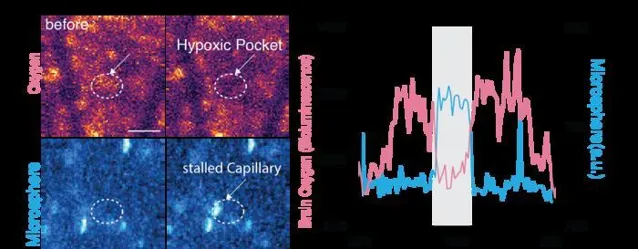
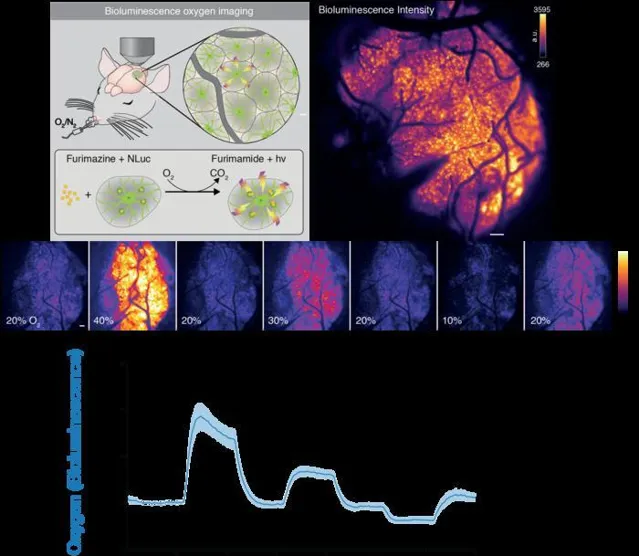 该图表明缺氧袋是由毛细血管停滞引起的。我们将微球引入小鼠的血液中,选择与白细胞相当的大小,白细胞主要负责毛细血管停滞。我们监测这些微球的荧光与组织氧合测量同时进行。顶部面板使用黄色和淡紫色的配色方案来描绘氧气水平,其中黄色表示高氧,淡紫色表示低氧。底部面板直观地以白色表示微球。右侧的折线图说明了氧气含量的时间变化。微球对毛细血管的闭塞,由蓝线的上升表示,导致氧浓度降低。在缺氧袋期间,如灰色阴影所强调的那样,微球荧光升高,同时组织氧合减少。[费利克斯·贝因利希]虽然现有的氧气监测技术提供了关于大脑非常小的区域的信息,但研究人员能够实时观察小鼠皮层的大部分。生物发光的强度与氧气的浓度相对应,研究人员通过改变动物呼吸的空气中的氧气量来证明这一点。光强度的变化也与感觉处理相对应。例如,当老鼠的胡须受到一股空气的刺激时,研究人员可以看到大脑的相应区域亮了起来。
该图表明缺氧袋是由毛细血管停滞引起的。我们将微球引入小鼠的血液中,选择与白细胞相当的大小,白细胞主要负责毛细血管停滞。我们监测这些微球的荧光与组织氧合测量同时进行。顶部面板使用黄色和淡紫色的配色方案来描绘氧气水平,其中黄色表示高氧,淡紫色表示低氧。底部面板直观地以白色表示微球。右侧的折线图说明了氧气含量的时间变化。微球对毛细血管的闭塞,由蓝线的上升表示,导致氧浓度降低。在缺氧袋期间,如灰色阴影所强调的那样,微球荧光升高,同时组织氧合减少。[费利克斯·贝因利希]虽然现有的氧气监测技术提供了关于大脑非常小的区域的信息,但研究人员能够实时观察小鼠皮层的大部分。生物发光的强度与氧气的浓度相对应,研究人员通过改变动物呼吸的空气中的氧气量来证明这一点。光强度的变化也与感觉处理相对应。例如,当老鼠的胡须受到一股空气的刺激时,研究人员可以看到大脑的相应区域亮了起来。
没有氧气,大脑就无法长期生存,中风或心脏病发作后迅速发生的神经损伤证明了这一概念。但是,当大脑的极小部分在短时间内被剥夺氧气时会发生什么?直到Nedergaard实验室的团队开始仔细研究新的录音,研究人员才提出这个问题。在监测小鼠时,研究人员观察到大脑的特定微小区域会变暗,有时会持续几分钟,这意味着氧气供应被切断。 「BLI的连续成像显示 PO 2在静息条件下具有高度动态性,表现出 局部瞬 态下降2.这些局部缺氧事件在空间上受到限制,持续数秒至数分钟,并且通常在相对组织 P O 中表现出急剧的开移和偏移2."
 该图表明,改变小鼠吸入的空气中的氧气浓度会影响脑组织内生物传感器的生物发光强度。具体来说,生物发光强度的增加表明大脑中氧浓度的增加。吸入空气中的氧气浓度每隔 60 秒改变一次。(薛丹、费利克斯·贝因利希)氧气通过庞大的动脉网络和渗透脑组织的较小毛细血管或微血管在整个大脑中循环。通过一系列实验,研究人员能够确定由于毛细血管停滞而导致氧气被拒绝,当白细胞暂时阻塞微血管并阻止携带氧气的红细胞通过时,就会发生这种情况。这些区域被研究人员命名为「缺氧口袋」,与动物活跃时相比,在休息状态下的小鼠大脑中更为普遍。「增加或阻断毛细血管流动的操作表明,微循环的局部中断是导致缺氧袋发生的原因,」该团队还指出。
该图表明,改变小鼠吸入的空气中的氧气浓度会影响脑组织内生物传感器的生物发光强度。具体来说,生物发光强度的增加表明大脑中氧浓度的增加。吸入空气中的氧气浓度每隔 60 秒改变一次。(薛丹、费利克斯·贝因利希)氧气通过庞大的动脉网络和渗透脑组织的较小毛细血管或微血管在整个大脑中循环。通过一系列实验,研究人员能够确定由于毛细血管停滞而导致氧气被拒绝,当白细胞暂时阻塞微血管并阻止携带氧气的红细胞通过时,就会发生这种情况。这些区域被研究人员命名为「缺氧口袋」,与动物活跃时相比,在休息状态下的小鼠大脑中更为普遍。「增加或阻断毛细血管流动的操作表明,微循环的局部中断是导致缺氧袋发生的原因,」该团队还指出。
毛细血管停滞被认为会随着年龄的增长而增加,并且已在阿尔茨海默病模型中观察到。「在阿尔茨海默病模型中观察到毛细血管停滞增加,引发了关于毛细血管停滞的长期影响及其在长期神经元活力中的潜在作用的问题,」科学家们指出。「缺氧诱导的缺氧诱导因子1a(HIF1a)表达增加通过破坏突触生理学和空间记忆来损害可塑性,」
「现在,研究与大脑缺氧相关的一系列疾病的大门是敞开的,包括阿尔茨海默氏症、血管性痴呆和长期COVID,以及久坐不动的生活方式、衰老、高血压和其他因素如何导致这些疾病,」Nedergaard说。「它还提供了一种工具来测试不同的药物和运动类型,以改善血管健康并减缓痴呆之路。
作者进一步得出结论,「我们的研究预测,缺乏身体活动对组织 P O有直接影响2通过有利于毛细血管闭塞和增加缺氧袋的数量。相反,简单地增加感觉输入或运动会迅速抑制缺氧袋的发生,也许可以解释久坐不动的生活方式与痴呆风险增加之间的联系。











