僅供醫學專業人士閱讀參考

慢性阻塞性肺疾病(COPD,簡稱慢阻肺病)是中國最常見的慢性呼吸系統疾病,已成為中國第三大死亡原因
[
1-
3
]
。雖然慢阻肺病已引起廣泛關註和積極防治,但患病率和死亡率仍持續攀升,這背後的原因除早期防控和規範化治療不到位等常見影響因素,也包括慢阻肺病具有多種臨床表型和炎癥內型,而這種異質性會帶來患者對治療的不同反應
[
3]
。那麽炎癥型別對慢阻肺病的診療有何影響?有沒有什麽新方法可以為當前的臨床診療方案提供改善的可能性?
伴 2 型炎癥特征的慢阻肺病患者,部份在三聯治療後仍控制不佳
慢性阻塞性肺疾病急性加重(acute exacerbations of chronic obstructive pulmonary disease,AECOPD)是導致患者死亡的 主要病因 [ 1-2 ] 。慢阻肺病患者每年發生0 .5~3.5次急性加重,是慢阻肺病自然病程中經常發生的臨床事件,慢阻肺病治療的主要目標之一就是減少和預防急性加重 [ 3] 。
作為一種異質性肺部病變,慢阻肺病具有多種分型。在病理生理學層面而言,其炎癥型別以嗜中性球炎癥為多見,但也有約1/3的患者屬於2型炎癥型別 [ 4,5] ,特點為嗜酸性球(eosinophils ,EOS)升高。相較於以嗜中性球驅動為主的非2型炎癥內型, 伴 2 型炎癥特征的慢阻肺病患者急性加重頻率更高 [ 5, 6 ] 。
有研究顯示 [7 , 8] ,當慢阻肺病患者血EOS計數≥200/μL時,其聖喬治呼吸問卷(St George's Respiratory Questionnaire,SGRQ)的評分更高、急性加重後的總住院時間更長。有文獻整合了兩項研究( COPDGene和ECLIPSE)的數據進行分析,結果發現隨著EOS計數增加,慢阻肺病急性加重的風險也在增加,當中重度慢阻肺病患者的 血EOS計數≥300/μL時,兩項研究的急性加重 發病率比值 (incidence rate ratio, IRR) 分別為1.32 (95%CI ,1.10-1.61) 和 1.22 (95% CI,1.06-1.41) [ 9 ] 。另一項研究結果顯示 [ 10] ,當 血 EOS計數 ≥ 340/μL時 , 重度急性加重的風險 是血EOS<3 40的患者的3.21倍(95% CI,2.49-4.14)。
【慢性阻塞性肺疾病全球倡議(GOLD)2023】提出 [ 6] ,對EOS≥300/μL的E組患者,考慮使用吸入糖皮質激素(inhalation corticosteroid,ICS)+長效抗膽堿能藥物(long-acting antimuscarinic antagonist,LAMA)+長效β2受體激動劑(long-actingbeta2-agonist,LABA)三聯治療。
國內【慢性阻塞性肺疾病診治指南】也指出,若患者血EOS計數≥300/μL同時癥狀較為嚴重[慢阻肺病患者自我評估測試(COPD Assessment test,CAT)大於20分],可考慮使用ICS+LAMA+LABA治療,三聯治療相較ICS+LABA,可能有更好的臨床療效 [11] 。
然而, 仍有30%~40%的慢阻肺病患者在接受三聯治療後,仍存在急性加重的風險 [12-13] 。那麽對於這些三聯治療後效果不佳的患者,尤其是EOS計數 ≥300/μL的伴2型炎癥特征的慢阻肺病患者,臨床又能提出怎樣的治療方案來改善療效呢?也許,我們可以從2型炎癥的機制方面來尋找方法。
治療新思路: 抑制 免疫應答或可行
2型炎癥以白血球介素(interleukin,IL)-4、IL-5及IL-13等2型細胞因子的表達上調為特征,其中IL-4和IL-13是驅動2型炎癥的重要細胞因子,可引起EOS被募集至炎癥反應區域並活化,進而導致總計數升高,以及B細胞的成熟、分化等 [1 4 -1 5] 。
啟用IL-4和IL-13通路可促進EOS和2型炎癥細胞在肺組織的浸潤,並導致慢阻肺病的病情加重,包括氣道反應性升高、上皮屏障功能障礙、氣道重塑、黏液腺高分泌、肺功能下降及黏膜纖毛功能障礙等病理生理過程 [ 1 6] 。
相關臨床研究顯示 [1 7 -1 8 ] ,透過藥物抑制中至重度支氣管哮喘患者的IL-4和IL-13訊號通路,可有效降低急性發作的頻率並改善肺功能。而支氣管哮喘的部份病理生理環節與慢阻肺病的2型炎癥類似 [ 1 5] 。因此,透過抑制IL-4和IL-13通路,減輕2型免疫反應,可能是治療慢阻肺病 2型炎癥的一種新方法。
基於這個機制,有沒有新的相關臨床研究呢?我們一起來了解。
臨床研究新進展:
度普利尤單抗在三聯基礎上可進一步降低急性加重發生率
[
16]
度普利尤單抗是一種靶向白血球介素-4受體亞基α(IL-4Rα)的全人源單複制抗體(IgG4型),能夠抑制IL-4和IL-13訊號傳導 [1 9 ] 。過往,度普利尤單抗已在治療支氣管哮喘的臨床研究中顯示出了較好的療效 [ 1 7 -1 8] 。今年7月,新英格蘭雜誌又釋出了一項新的臨床研究,揭示將度普利尤單抗套用於慢阻肺病伴2型炎癥特征患者治療的療效 [1 6 ] 。
該研究共納入939例慢阻肺病患者,其中度普利尤單抗組468例,安慰劑組471例,結果顯示度普利尤單抗組中重度急性加重年發生率顯著低於安慰劑組(圖 1)。

圖1 中重度急性加重的累積情況 [ 16]
此外,度普利尤單抗組治療2周,吸入支氣管擴張劑前的第1秒用力呼氣量(FEV 1 )即開始出現明顯改善。治療第12周,度普利尤單抗組的支氣管擴張劑前FEV 1 最小平方(LS)平均值為160 mL,顯著高於安慰劑組的77 mL,相差83 mL,且療效持續至治療第52周(圖2),顯示出度普利尤單抗可以減少伴 2型炎癥特征的慢阻肺病患者急性加重次數,並改善肺功能。SGRQ評分和慢阻肺病呼吸系統癥狀量表(evaluating respiratory symptoms in COPD,E-RS-COPD)評分均有明顯的改善。
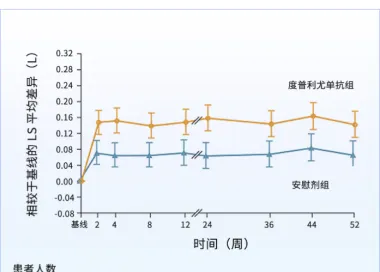
圖2 支氣管擴張劑前的FEV 1 變化 [ 16]
在基線呼出氣一氧化氮(FeNO)水平為 ≥ 20 ppb的患者中,度普利尤單抗組的中重度急性加重年發生率為0.70,遠低於安慰劑組的1 .12(RR =0.62;9 5% CI,0.45 – 0.87;P =0.005) [ 16] 。
小結
慢阻肺病患者發病機制較為復雜,雖然目前推薦對血EOS計數≥300/μL的E組患者套用 ICS+LAMA+LABA三聯治療,但仍有部份患者在三聯治療後控制不佳。而度普利尤單抗的臨床研究顯示其透過抑制IL-4/IL-13訊號傳導,對伴2型炎癥特征的慢阻肺病患者起到了較好的療效,或可成為一種新的治療選擇。
參考文獻:
[1]慢性阻塞性肺疾病臨床診治實施規範專家組. 慢性阻塞性肺疾病臨床診治實施規範. 國際呼吸雜誌,2022,42(06):401-409.
[2]中華醫學會呼吸病學分會慢性阻塞性肺疾病學組,中國醫師協會呼吸醫師分會慢性阻塞性肺疾病工作委員會. 慢性阻塞性肺疾病急性加重高風險患者辨識與管理中國專家共識. 國際呼吸雜誌,2022,42(24):1845-1863.
[3]慢性阻塞性肺疾病急性加重診治專家組.慢性阻塞性肺疾病急性加重診治中國專家共識(2023年修訂版)[J].國際呼吸雜誌,2023,43(2):132-149.
[4] H alpin DMG, de Jong HJI, Carter V, Skinner D, Price D. Distribution, Temporal Stability and Appropriateness of Therapy of Patients With COPD in the UK in Relation to GOLD 2019. EClinicalMedicine. 2019 Jul 24;14:32-41.
[5]夏蓉,孫鵬,姚欣.慢性阻塞性肺疾病2型炎癥相關研究進展[J].中華健康管理學雜誌,2023,17(4):311-315.
[6]Global initiative for chronic obstructive lung disease Global strategy for the diagnosis management and prevention of chronic obstructive pulmonary disease 2023report
[7]Hastie Annette T,Martinez Fernando J,Curtis Jeffrey L et al. Association of sputum and blood eosinophil concentrations with clinical measures of COPD severity: an analysis of the SPIROMICS cohort.[J] .Lancet Respir Med, 2017, 5: 956-967.
[8]Barnes Neil C,Sharma Raj,Lettis Sally et al. Blood eosinophils as a marker of response to inhaled corticosteroids in COPD.[J] .Eur Respir J, 2016, 47: 1374-82.
[9]Yun Jeong H,Lamb Andrew,Chase Robert et al. Blood eosinophil count thresholds and exacerbations in patients with chronic obstructive pulmonary disease.[J] .J Allergy Clin Immunol, 2018, 141: 2037-2047.e10.
[10]Vedel-Krogh Signe,Nielsen Sune F,Lange Peter et al. Blood Eosinophils and Exacerbations in Chronic Obstructive Pulmonary Disease. The Copenhagen General Population Study.[J] .Am J Respir Crit Care Med, 2016, 193: 965-74.
[11]中華醫學會呼吸病學分會慢性阻塞性肺疾病學組,中國醫師協會呼吸醫師分會慢性阻塞性肺疾病工作委員會.慢性阻塞性肺疾病診治指南(2021年修訂版)[J].中華結核和呼吸雜誌,2021,44(3):170-205.
[12]Sridhar Sriram,Liu Hao,Pham Tuyet-Hang et al. Modulation of blood inflammatory markers by benralizumab in patients with eosinophilic airway diseases.[J] .Respir Res, 2019, 20: 14.
[13]Pavord ID, et al. Mepolizumab for Eosinophilic Chronic Obstructive Pulmonary Disease. N Engl J Med. 2017 Oct 26;377(17):1613-1629.
[14]Gandhi Namita A,Bennett Brandy L,Graham Neil M H et al. Targeting key proximal drivers of type 2 inflammation in disease.[J] .Nat Rev Drug Discov, 2016, 15: 35-50.
[15]中華醫學會變態反應學分會.2型炎癥性疾病機制及靶向治療專家共識[J].中華醫學雜誌,2022,102(42):3349-3373.
[16]Bhatt Surya P,Rabe Klaus F,Hanania Nicola A et al. Dupilumab for COPD with Type 2 Inflammation Indicated by Eosinophil Counts.[J] .N Engl J Med, 2023, 389: 205-214.
[17]Rabe Klaus F,Nair Parameswaran,Brusselle Guy et al. Efficacy and Safety of Dupilumab in Glucocorticoid-Dependent Severe Asthma.[J] .N Engl J Med, 2018, 378: 2475-2485.
[18]Castro Mario,Corren Jonathan,Pavord Ian D et al. Dupilumab Efficacy and Safety in Moderate-to-Severe Uncontrolled Asthma.[J] .N Engl J Med, 2018, 378: 2486-2496.
[19]度普利尤單抗說明書.
聲明:度普利尤單抗尚未獲批慢阻肺病適應癥,目前在中國僅批準用於治療6個月及以上中重度特應性皮炎(AD)和成人中重度結節性癢疹(PN)和12歲及以上青少年和成人哮喘患者的維持治療。
MAT-CN-2331941,version 1,批準日期2023年12月,本編號僅作為賽諾菲對本文章所涉及的賽諾菲相關藥物所屬治療領域科學和臨床數據來源真實性的確認,不作為賽諾菲對本文章全部內容準確性、時效性和完整性的確認和保證;本文章僅供醫療衛生專業人士為學術交流或了解醫學資訊目的使用,不構成對任何藥物或治療方案的推薦和推廣。本文章所含資訊不應代替醫療衛生專業人士提供的醫療建議。
,學習更多臨床技能











