降脂 、 調節血糖和體重 還可以這樣
合作單位:Chongqing Medical University
參考文獻:Zhao Y, Li Y, Wang F, et al. CES1-Triggered Liver-Specific Cargo Release of CRISPR/ Cas9 Elements by Cationic Triadic Copolymeric Nanoparticles Targeting Gene Editing of PCSK9 for Hyperlipidemia Amelioration. Advanced Science, 2023, 10(19): 2300502. doi: 10.1002/advs.202300502. (IF=14.3)
背景:
基因組編輯系統正在成為生物醫學研究、基因藥物開發甚至基因治療的基礎。在所有的基因編輯工具中,CRISPR/ Cas9因其簡單、靈活和有望一次性治愈遺傳性疾病,在疾病治療策略的研究中顯示出巨大的優勢。一些基於CRISPR/ cas9的臨床試驗也正在進行或即將開始,例如用於癌癥治療的嵌合抗原受體t細胞免疫療法和靶向肝臟的基因編輯療法用於降脂治療。然而,如何將CRISPR/ Cas9組分安全有效地遞送和釋放到靶器官、細胞和細胞核中仍然是基因組編輯介導的疾病治療的主要挑戰,這將直接影響該系統的成功和治療套用。
脂質體、聚合物和無機奈米顆粒在CRISPR/ Cas9遞送中顯示出優勢。相比之下,脂質體和無機奈米顆粒、聚合物表現出優異的模組化和易於功能化,可以很容易地從合成單體或預制聚合物中制備,這可以在制備過程中精確控制奈米顆粒的各種性質。聚合物也具有不同的藥物遞送能力,聚合物奈米顆粒可以遞送不同的藥物,包括不同分子量的化合物,如小分子、生物大分子和蛋白質,可以滿足不同的CRISPR/Cas9共遞送形式(Cas9- mRNA /sgRNA、質體和Cas9/sgRNA核糖核蛋白)的需求。因此,它們被認為是CRISPR/Cas9的優秀傳遞平台。此外,對影響基因傳遞和編輯過程的CRISPR/Cas9聚合物的研究也引起了廣泛的興趣,包括表面電荷的型別、聚乙二醇化程度、CRISPR/Cas9的型別以及靶組織的位置。
陽離子共聚物主導CRISPR/ Cas9傳遞,因為CRISPR/ Cas9組分的高負載潛力和透過靜電交互作用的細胞吸收效率,隨著RAFT聚合的出現。已經開發了幾種用於siRNA遞送的陽離子共聚物載體。然而,與短sgRNA共遞送更大的Cas9-mRNA分子或Cas9蛋白仍然具有挑戰性。更重要的是,陽離子部份由於幹擾細胞膜完整性而容易引起細胞毒性。到目前為止,幾乎沒有陽離子聚合物奈米材料被食品和藥物管理局批準用於臨床。設計和合成無害的陽離子共聚物傳遞體系來解決這些問題是必要的。
二甲雙胍是2型糖尿病的一線藥物治療,這種陽離子藥物已經顯示出療效和良好的安全性。最近的報道表明,胍基功能化的聚合物可以透過Gu+/ PO34-靜電和氫鍵交互作用很容易地粘附在核酸上。因此,二甲雙胍可能是設計具有內在降糖活性的安全陽離子基因載體的理想聚合物單體。然而,這些交互作用增強了核酸和胍基團之間的穩定性,通常導致細胞內釋放不良,從而導致效率低下。在保持穩定性的同時解決釋放問題也是研究的一個理想目標。
羧酸酯酶(CES)是將羧酸酯酶水解成相應的醇和羧酸的酯酶家族成員。羧酸酯酶1 (CES1)和羧酸酯酶2 (CES2)是參與外源代謝的兩種主要酶。盡管CES1和CES2具有一定的序列同源性,但它們表現出不同的分布和受質特異性。例如,CES1在肝臟中大量表達,而CES2主要在小腸和結腸中表達。此外,CES1優先代謝含有小醇基和大酰基的酯鍵。與CES1相反,CES2優先水解含有較大醇基和較小酰基的酯。因此,假設在陽離子共聚物中加入一個簡單的CES1活性丙酯單體可以實作多種效果。首先,在陽離子共聚物中加入疏水力,使其能夠有效地封裝核酸。其次,減少一些正電荷可以進一步降低潛在的細胞毒性。第三,這種結構有助於陽離子共聚物選擇性地從肝細胞中釋放RNA。第四,經CES1活化後,丙酯水解成相應的醇和羧酸,並帶負電荷。這種負電荷可以競爭性地幹擾雙胍類化合物與核酸之間的靜電和氫鍵交互作用,促進核酸的進一步釋放。
本文首次設計並制備了肝臟CES活化的二甲基雙胍三元共聚物(mPEG-b-P(Met/n-PMA))。采用RAFT聚合技術將胍和丙酯單體共聚到甲氧基聚乙二醇修飾的4-氰基-4-(苯基硫代甲酰基硫)戊酸(mPEG-CPADN)上。mPEG是增加親水性以降低陽離子共聚物毒性的另一理想選擇,因為它通常用於修飾陽離子共聚物以減少蛋白質吸附,提高核酸轉染效率。由梳狀聚合物組成的聚乙二醇沒有表現出任何明顯的毒性作用。如圖1所示,選擇肝(PCSK9作為治療靶點,以證明共聚物作為Cas9-mRNA/ sgPCSK9的奈米載體,可降低血漿低密度脂蛋白-膽固醇(LDL-C)水平,改善高脂血癥。有趣的是,除了降脂作用外,還發現了這種策略在調節血糖和體重方面的雙重作用。

圖1使用mPEG-b-P(Met/n-PMA)遞送Cas9-mRNA/sgPCSK9改善高脂血癥的示意圖
方案設計:
為了研究RNA的負載能力。透過與魔德科技技術團隊溝通,擬采用分子對接和分子動力學模擬方法研究mPEG-b-P(Met/n-PMA)與RNA (mPEG-b-P(Met/n-PMA)/ RNA)之間的自組裝機制和程度。
主要結果:
大分子設計與合成
本研究首先合成了mPEG-CPADN鏈轉移試劑(化合物5)(圖2A)。隨後,N-(2-(3-胺基甲酰胍)乙基)甲基丙烯醯胺(化合物3)和N-甲基丙烯酸丙酯(化合物6)單體以mPEG-CPADN和偶氮二異丁腈(AIBN)為宏觀引發劑,進行RAFT共聚得到mPEG-b-P(Met/ N- PMA)。合成過程在實驗部份描述,如圖2A所示。化合物結構透過H- NMR、C-NMR和紅外光譜進行確認(圖2B)。進一步的紫外光譜分析和凝膠滲透色譜分析表明,mPEG-b-P(Met/n-PMA)的分子量為≈10,000 MW,在305 nm處有紫外吸收峰。
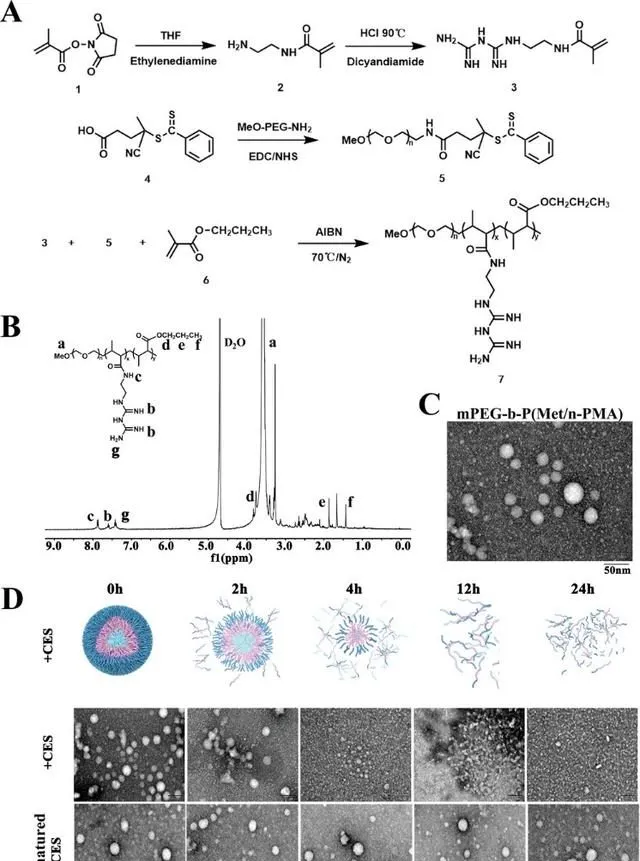
圖2 mPEG-b-P(Met/n-PMA)的形成、表征和分解
RNA 負載能力 的分子動力學模擬
為了深入了解mPEG-b-P(Met/n-PMA)與RNA (mPEG-b-P(Met/n-PMA)/ RNA)之間的自組裝機制和程度,采用分子動力學(MD)模擬方法模擬了mPEG-b-P(Met/n-PMA)/RNA的形成過程。在典型的模擬過程中,構建了能量最佳化的RNA和mPEG-b-P(Met/n-PMA) 3D模型。然後,將8個mPEG-b-P(Met/n-PMA)分子和1個RNA分子溶劑化到15 cm × 15 cm × 15 cm的立方水盒中,結果表明,經過100 ns後,所有分子都自組裝成球形顆粒(圖3A)。結果表明,mPEG-b-P(Met/n-PMA)中的氧原子和氮原子與RNA形成氫鍵,而亞甲基則與RNA形成層合。圖3B顯示了RNA和mPEG-b-P(Met/n-PMA)的均方根偏差(RMSD)的變化。RNA的RMSD在整個模擬過程中略有波動,說明RNA分子在整個模擬過程中是相對穩定的。mPEG-b-P(Met/n-PMA)的RMSD在模擬開始時發生顯著變化並趨於穩定,表明mPEG-b-P(Met/n-PMA)與RNA可以組裝形成穩定的奈米顆粒。接下來,使用GROMACS能量模組探索mPEG-b-P(Met/n-PMA)和RNA之間的能量大小(圖3C)。這一結果表明,隨著配合物的持續聚集,靜電(源於氫鍵交互作用)和範德華能得到增強。如圖3D所示,mPEG-b-P(Met/n-PMA)與RNA之間的氫鍵數增加,而RNA與水之間的氫鍵數減少,說明氫鍵是mPEG-b-P(Met/n-PMA)與RNA聚集的主要驅動力。在PEG-PMet與RNA的自組裝過程中,暴露在溶劑中的面積逐漸減小;因此,溶劑可及表面積(SASA)可用於評價球形顆粒的自組裝緊密性。另外,PEG-PMet/RNA復合物的SASA值下降並趨於穩定,說明PEG-PMet與RNA聚集自組裝成穩定的膠束。此外,SASA在模擬後期保持穩定,表明簇結構沒有因溶劑的影響而解離。
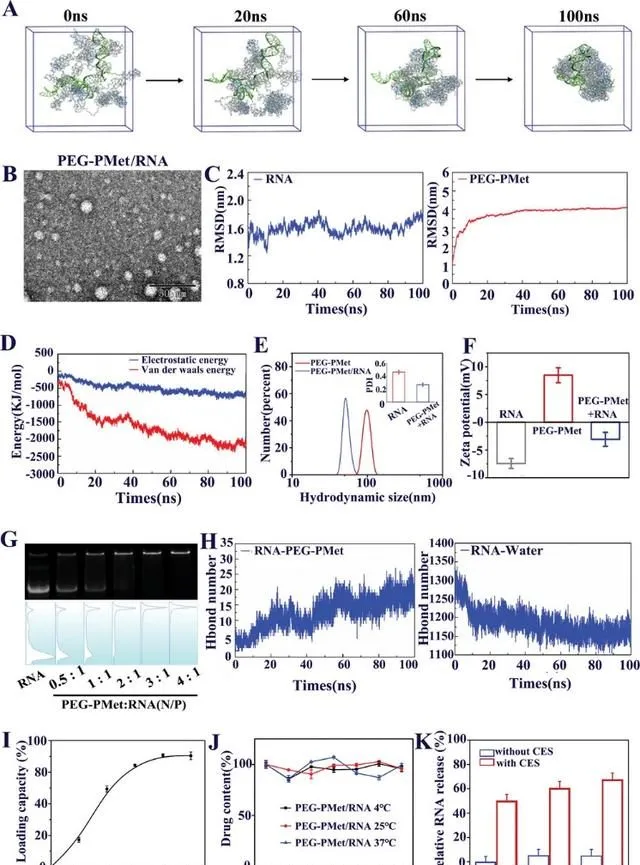
圖3 mPEG-b-P(Met/n-PMA)的RNA裝載和釋放能力
mPEG - b -P(Met/n-PMA) 調節體重增加和緩解胰島素抵抗
在體內評估mPEG-b-P(Met/nPMA)的有效性和安全性時,發現mPEG-b-P(Met/n-PMA)對體重控制的作用過大。與Lipo3000和二甲雙胍相比,mPEG-b-P(Met/n-PMA)減輕了高脂飲食(HFD)誘導的體重增加。因此,監測了mPEG-b-P(Met/n-PMA)對血糖水平的影響。首先,在給藥前進行葡萄糖耐量試驗(GTT)和胰島素耐量試驗(ITT),並與正常飲食(NCD)進行比較。HFD、mPEG-b-P(Met/nPMA)和Lipo3000的GTT和ITT均有改善,提示小鼠出現輕度葡萄糖和胰島素抵抗。給藥14 d後,與Lipo3000和HFD相比,mPEG-b-P(Met/n-PMA)的GTT和ITT降低,表明mPEG-b-P(Met/n-PMA)改善了葡萄糖和胰島素抵抗。
結論:
透過設計、合成和表征新型mPEG-b-P(Met/n-PMA),該文發現mPEG-b-P(Met/n-PMA)可以透過靜電和範德華交互作用將核酸形成穩定的奈米膠束,並且mPEG-b-P(Met/n-PMA)可以被肝臟中的CES選擇性啟用和分解。這些奈米膠束在體內和體外都能將核酸輸送到肝細胞。這種遞送策略實作了PCSK9的高效基因組編輯和血清LDLC的下調。值得註意的是,除了降脂作用外,該策略還具有調節血糖和體重的雙重作用。然而,mPEG-b-P(Met/n-PMA)調節血糖和體重的機制、藥代動力學和藥效學尚不清楚。綜上所述,這些數據證明進一步探索核酸載體二甲雙胍是有必要的。此外,mPEG-b-P(Met/n-PMA)介導的PCSK9基因編輯具有改善高脂血癥的潛力。










![[ 內蒙古日報]世界過敏性疾病日丨有些食物不喜歡吃?很有可能是你對它過敏!](http://img.jasve.com/2024-7/ce62827d1fe87e4d9da226ef81cc18c3.webp)
