血栓形成是在血管內流動著的血液凝固或某些有形成分凝集形成固體塊,引起血管部份或完全堵塞,導致相應部位血液供應障礙的病理過程。當這種情況發生時,血栓會阻礙血液流動,或者脫落,去到身體的其它地方。如果血栓卡在肺或大腦等關鍵部位,就會阻礙流向那個器官的血液,導致危及生命的緊急情況。
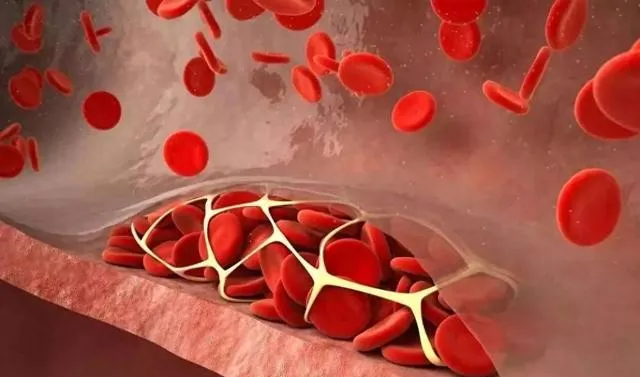
血栓可在動脈形成,也可在靜脈形成。動脈負責將血液從心臟輸送到身體的其它部位,動脈血栓形成是心臟病發作和中風的最常見原因;靜脈負責將血液從身體輸送回心臟,靜脈血栓形成是肺栓塞最常見的原因。
血栓形成極為常見,研究顯示全球四分之一的住院患者死亡原因與血栓栓塞有關。血栓形成在患有某些疾病的人群中更為常見,包括房顫、癌癥、冠狀動脈疾病、糖尿病以及凝血障礙(比如抗磷脂症候群)。
血栓形成可導致許多不同的並行癥,這取決於血栓形成或移動的位置:
血栓形成的原因是什麽?
當某些東西破壞血管內壁或減慢血液流動時,就會形成血栓,無論哪種情況,都是血液中的細胞在不應該粘在一起的時候開始粘在一起。
正常情況下,我們血液中的許多細胞和諧共存,並在需要完成某項工作時聚集在一起。例如,如果有傷口,血小板和蛋白質會在受傷部位結合在一起,起到止血的作用。這一過程形成一個必要的血凝塊,防止失去太多的血液。傷口愈合後,血塊就會溶解。這就像工作中的緊急會議,每個人都擠在一張桌子前,問題解決後,每個人都離開,各奔東西。
但是,各種醫學狀況、藥物和其它因素都可能導致我們的血液成分在不需要的時候聚集在一起,或者在應該溶解的時候不能溶解。
機體要維持體內血液正常的流動狀態和防止血液遺失,需要維持凝血和抗凝之間的動態平衡。機體的正常凝血依賴於完整的血管壁結構和功能,有效的血小板品質和數量,正常的血漿凝血因子活性。血小板和凝血因子是生理性凝血的重要成分。組織因子是唯一不存在於正常人血漿中的凝血因子,它存在於血管內皮細胞、單核球、巨噬細胞上。炎癥和感染等可促使組織因子合成和表達,並可釋放到血漿中。各種原因引起組織因子活性的升高將會導致血管內血栓形成,從而引發多種疾病。組織因子不僅參與血栓形成的始動過程, 而且還參與血栓的不斷增大以及血栓形成的整個過程。血液迴圈中的組織因子不斷覆蓋在血栓表面, 反復啟動凝血, 最終使血栓不斷增加。抗凝系統對凝血過程進行負調節,人體最主要的抗凝系統包括組織因子途徑抑制物。凝血和抗凝之間的失衡可能導致血栓形成。
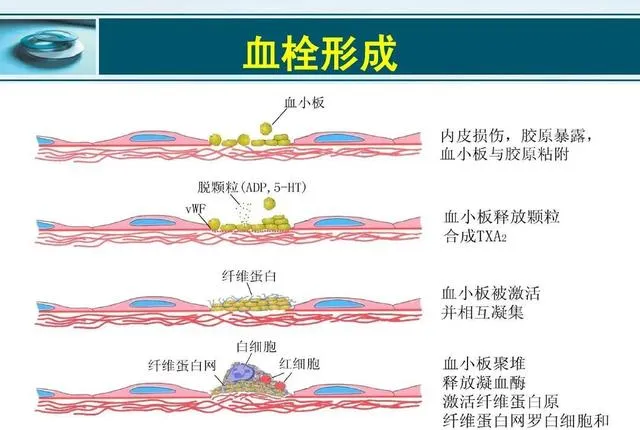
血栓形成是血小板粘附在血管內皮損傷後裸露的膠原表面,粘附的血小板會釋放出二磷酸腺苷和血栓素A2等物質促使更多的血小板粘附、聚集形成血小板血栓,形成血栓頭部;血管內皮的損傷也會啟用內源性和外源性凝血系統,在血小板小梁之間的血液發生凝固,纖維蛋白形成網狀結構,網內充滿大量的紅血球,形成血栓體部;最後局部血流停止、血液凝固,形成血栓尾部。
血栓形成的機制很復雜,是遺傳和環境危險因素共同作用的結果。因此,迫切需要確定可改變的危險因素,以預防血栓形成事件,進而預防不良的長期結果。腸道菌群在人類健康的各個方面發揮重要作用,從而對宿主生理產生重要影響。腸道菌群是許多慢性疾病的可改變的宿主因素。各種環境或遺傳因素對腸道菌群的幹擾會導致血管內皮細胞、血小板和先天免疫細胞中炎癥通路的啟用,從而釋放各種凝血蛋白,導致促血栓形成的狀態。
腸道菌群誘導血栓形成的機制
1、代謝物產生
腸道菌群誘導血栓形成的一種機制是透過腸道菌群產生的代謝物。腸道微生物可以利用飲食中的成分,並能改變宿主體內代謝物的產生。
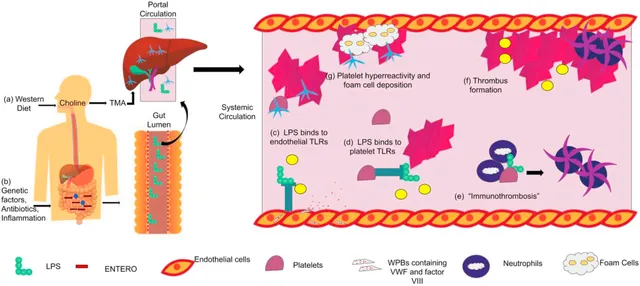
腸道細菌會將膽堿、肉堿和磷脂酰膽堿等營養物質代謝為三甲胺,然後三甲胺會在肝臟被氧化為氧化三甲胺。氧化三甲胺一旦進入體迴圈,會導致血小板高反應性,並在動脈粥樣硬化的早期階段增加泡沫細胞的沈積。西式飲食富含這些營養物質,會促進腸道中增加三甲胺產生的微生物的富集。較高的血漿氧化三甲胺水平與心血管疾病和血栓形成事件的不良結局有關。
血漿氧化三甲胺水平被認為與冠狀動脈粥樣硬化斑塊負荷相關,而且是人類心血管疾病的獨立預測因子。氧化三甲胺會增加富含膽固醇的巨噬泡沫細胞在血管上沈積,這是動脈粥樣硬化性疾病發生的最早步驟之一。腸道菌群在這方面發揮重要作用,因為富含膽堿的飲食會增加動脈粥樣硬化,而使用抗生素清除腸道菌群會抑制這種反應,即使在富含膽堿的飲食中也是如此。
在小鼠血栓模型中,補充膽堿的小鼠中較高水平的氧化三甲胺與氯化鐵誘導血管損傷後較短的凝血時間相關。此外,當給無菌小鼠單獨補充膽堿時,對凝血時間沒有影響,因此,腸道菌群在氧化三甲胺的促血栓形成表型中發揮關鍵作用。
富含膽堿的飲食會透過增加厚壁菌門和變形菌門細菌來誘導腸道菌群失調,將這些微生物移植到無菌小鼠腸道中,會導致血小板反應性和血栓形成增加。氧化三甲胺不直接刺激血小板,但會增強鈣離子的釋放和血小板激動劑的啟用。
3,3-二甲基-1丁醇(DMB)是一種膽堿結構類似物,可以透過抑制腸道微生物裂解酶三甲胺來減少三甲胺的產生,從而降低氧化三甲胺的水平。透過使用DMB降低氧化三甲胺水平可以減少動脈粥樣硬化病變的大小。

其它與心血管疾病風險相關的微生物代謝物有膽汁酸和短鏈脂肪酸。膽汁酸在肝臟中由膽固醇合成,對糞便中膽固醇的排出至關重要。腸道菌群的改變會減少膽汁酸的合成,導致膽固醇排出減少,增加心血管疾病的風險。短鏈脂肪酸是腸道微生物發酵不可消化的膳食纖維產生的,雖然高水平的短鏈脂肪酸通常被認為具有抗炎作用,但如果不受控制,可能是心血管疾病的危險因素。
2、炎癥和腸道菌群失調
炎癥是靜脈血栓栓塞的重要危險因素。炎癥會啟用內皮細胞、血小板和白血球啟動凝血。它也會導致消耗性凝血病和促炎細胞因子、趨化因子和各種白血球亞型的增加。
肥胖、敗血癥/感染、炎癥性腸病和腸衰竭等炎癥狀態都與靜脈血栓栓塞的高發病率相關。同時,它們也與腸道菌群失調有關。遺傳和許多環境因素也可導致腸道菌群失調,表現為微生物多樣性減少,有益微生物減少,而一些病原菌過度生長,比如腸桿菌科細菌。腸桿菌科細菌是革蘭氏陰性兼性厭氧菌,在有氧或無氧的情況下都能生長,而且被認為是有害的、致病性的和促炎的細菌。腸桿菌科細菌的增加會導致腸腔內LPS的產生增加。LPS透過受損的腸道上皮屏障轉運進入門靜脈,然後進入體迴圈。
LPS是腸道菌群失調和血栓形成之間的聯系之一,這是存在於革蘭氏陰性細菌外膜上的一種糖脂類。LPS是一種熱穩定的內毒素,可以透過局部或全身感染進入血液。
在敗血癥中,患者的LPS水平比健康對照組高100倍,這會導致炎癥細胞因子的過度產生和革蘭氏陰性感染性休克的臨床表現,比如器官衰竭、低血壓、呼吸窘迫以及凝血級聯反應失調引起的彌散性血管內凝血。
代謝性內毒素血癥是一種血漿LPS水平長期升高的疾病,會導致慢性炎癥狀態,但是LPS水平要比敗血癥低10-50倍。代謝性內毒素血癥是由細菌及其內毒素(比如LPS)透過易位進入身體迴圈引起的。
代謝性內毒素血癥已被證明存在於各種疾病狀態中,比如動脈粥樣硬化、自身免疫性疾病、代謝症候群、肝硬化、抑郁癥、2型糖尿病、肥胖、創傷性腦損傷、多器官衰竭等等。在炎癥性腸病中,患者腸道菌群中腸桿菌科細菌的豐度與血清LPS水平升高有關。肝硬化患者同樣有較高水平的血清LPS,繼發於細菌及其產物從腸腔轉位進入門靜脈和體迴圈。這些發現也在小鼠模型中得到了證實,因為高脂飲食會誘導小鼠腸道菌群的變化,導致革蘭氏陰性菌的豐度增加和腸道通透性增加,從而導致LPS易位進入體迴圈,從而導致代謝性內毒素血癥。
最早的測量代謝性內毒素血癥中低水平的LPS的方法就是利用LPS的促凝血作用。有一種形似蟹狀的海生節肢動物叫做鱟,它的血液對LPS非常敏感,在LPS的存在下會發生凝結,透過測量鱟血液中凝血級聯反應的啟用來確定患者血漿中是否存在LPS。
LPS水平升高導致的高凝狀態,在各種疾病狀態和小鼠模型中已經得到證實。在肝硬化患者中,血清LPS水平升高與凝血因子VIII水平、血管性血友病因子和凝血酶生成呈正相關。腸內不可吸收抗生素的使用可以導致LPS水平降低,並伴隨凝血酶產生的減少。同樣,在炎癥性腸病患者中,LPS水平與D-二聚體和凝血酶原片段水平相關,並且這種相關性在結腸疾病患者中更強,因為結腸中的細菌負荷比胃腸道其它部份更高。在氯化鐵誘導的小鼠血管損傷模型中,LPS會促進血栓形成,即使在沒有引起血管損傷的較低氯化鐵濃度下,LPS也會增強血栓形成。
3、Toll樣受體通路與高凝血狀態
LPS是透過Toll樣受體(TLR)啟用先天免疫系統的關鍵因子,這一受體在免疫細胞和非免疫細胞上均有表達,包括巨噬細胞、淋巴細胞、內皮細胞、樹狀細胞和血小板。Toll樣受體也是先天免疫系統的關鍵啟用因子,可辨識細菌、病毒和真菌中的相關分子,在先天免疫系統的啟用中發揮關鍵作用。
目前已經發現了10多種不同的toll樣受體,其中研究最多的是TLR2和TLR4,它們在有核內皮細胞、白血球和血小板上表達。血小板TLR是「血栓性炎癥」的橋梁,其作用包括炎癥、血小板粘附和聚集以及嗜中性球胞外誘捕網的形成。也有研究表明,較高水平的TLR表達可能與心血管風險和炎癥生物標誌物相關。
TLR4是LPS在有核細胞和血小板上的主要受體。在炎癥性腸病患者的臨床研究中,LPS水平與TLR4濃度呈正相關,LPS-TLR4訊號通路在引發炎癥性腸病患者的凝血中發揮作用。 對LPS水平升高的肝硬化患者的血小板進行的離體研究顯示,與健康對照相比,低於閾值濃度的常見激動劑(比如腺嘌呤二磷酸或膠原蛋白)就可以促進血小板聚集增加,而與血小板計數無關,當TLR4被抑制時,這種反應也減弱了。
TLR4存在於含有懷布爾-帕拉德小體(webel-palade body)的內皮細胞上,懷布爾-帕拉德小體可以儲存和釋放血管炎癥調節因子,包括血管性血友病因子、凝血因子VIII和P選擇素。LPS啟用內皮細胞上的TLR4,導致促炎細胞因子的釋放以及懷布爾-帕拉德小體胞吐釋放凝血因子VIII和血管性血友病因子,促進高凝血狀態。
在血小板上,TLR4透過增加與嗜中性球的結合、嗜中性球胞外誘捕網的形成以及組織蛋白介導的血小板反應,來調節血小板與嗜中性球的交互作用,從而增加凝血酶的產生。
內皮細胞和血小板上也發現有TLR2。TLR2通常與TLR1或TLR6形成異源二聚體,辨識革蘭氏陽性菌和一些革蘭氏陰性菌上的多種肽聚糖。
TLR2通路對內皮細胞至關重要,肝內皮細胞上的TLR2受體啟用會導致血管性血友病因子增加,動脈血栓生長增加。無菌小鼠和TLR2缺陷小鼠的血栓形成減少,因此,腸道菌群對TLR2的啟用非常重要。此外,用TLR2激動劑處理人臍靜脈內皮細胞會導致促凝作用,增加組織因子、纖溶酶原啟用物抑制劑-1的產生,減少組織纖溶酶原啟用物和組織因子途徑抑制物的產生。
同時,LPS與血小板上的TLR結合,會導致血小板活化,α-顆粒和致密顆粒的釋放以及細胞因子的釋放,增加血栓形成風險。
4、LPS與凝血級聯反應
內毒素血癥中LPS水平升高可直接啟用血管舒緩素-激肽系統。血管舒緩肽的產生可啟用接觸因子,從而啟用內源性凝血系統並裂解高分子量的激肽原,從而釋放促炎介質緩激肽。激肽原也是一個重要的LPS載體,因為缺乏激肽原的小鼠對LPS誘導的死亡有抵抗力,補充激肽原可以恢復動物的易感性。
在單核球中,接觸因子誘導的白血球介素IL-1的釋放在LPS的存在下會大大增加。此外,接觸因子處理的脾樹狀細胞暴露於LPS,會產生更高數量的IL-6和IL-23。
LPS也能影響外源性凝血級聯反應。在凝血級聯反應中,磷脂酰絲胺酸透過增加組織因子與凝血因子VII的結合以及輔因子-蛋白酶復合物的形成來增強組織因子的活性。磷脂酰絲胺酸通常存在於質膜的內小葉中,在LPS的存在下,會翻轉到質膜的外小葉,導致組織因子啟用。
外源性途徑與內毒素血癥之間也存在重要聯系,因為抑制組織因子可以防止內毒素血癥誘導的彌散性血管內凝血。血小板高反應性、凝血因子的釋放、細胞因子的釋放和嗜中性球胞外誘捕網的形成共同作用,可導致高凝狀態,並可能導致血栓形成。
5、免疫性血栓形成
免疫性血栓形成是透過招募先天免疫細胞和血小板,在血管中形成血栓,引起先天免疫反應,辨識、遏制和破壞病原體,阻止病原體的傳播。嗜中性球、單核球和樹狀細胞共同作用,透過纖維蛋白形成和血小板活化啟動,抑制病原體在脈管系統中的傳播。「免疫血栓」不同於原發性和繼發性止血過程,因為它主要發生在血管內腔,可能是預防病理性血栓形成的一種新的治療選擇。止血和免疫血栓形成都是阻止失血和血管內病原體的傳播,但異常啟用可導致常見於心血管疾病和深靜脈血栓中的病理性血栓形成。
嗜中性球是先天免疫的主要效應因子,在宿主防禦和血栓形成中具有雙重功能。它們與血小板在血管損傷部位迅速聚集,可促進心血管疾病大血管血栓形成。啟用後,嗜中性球會釋放嗜中性球胞外誘捕網, 這是由DNA纖維、組織蛋白和抗菌蛋白組成的網狀結構,負責捕獲和殺死細胞外病原體,在抗菌防禦中發揮保護作用。然而,它們也可以誘導強烈的促凝反應,並透過導致炎癥性疾病和輸血相關性急性肺損傷等病理後果對組織造成傷害。
免疫血栓中,嗜中性球胞外誘捕網的形成會導致血小板與嗜中性球交互作用,啟用接觸因子並促進聚集。嗜中性球胞外誘捕網的胞外核小體的組織蛋白組分可以啟用TLR2和TLR4。啟用的嗜中性球會沈積絲胺酸蛋白酶,使一些重要的抗凝劑失活,比如組織因子途徑抑制劑和血栓調節蛋白,從而導致高凝血狀態。
嗜中性球胞外誘捕網還可以透過啟用接觸因子,並結合血管性血友病因子,促進血小板募集和活化。TLR4通路還透過增加內皮細胞內重要粘附分子的表達,包括細胞間粘附分子-1,誘導嗜中性球胞外誘捕網的形成。
此外,在臨床前模型中,用分解嗜中性球胞外誘捕網的去氧核糖核酸酶處理小鼠,阻斷嗜中性球胞外誘捕網的形成,可以防止血栓形成。
血小板透過病原體辨識和先天免疫細胞參與的促血栓形成通路的增強,在免疫血栓形成中發揮關鍵的支持作用。血小板會與血液中的細菌上的LPS結合,並將這些病原體呈遞給嗜中性球和其它先天免疫細胞。
在動脈血栓中,它們是第一批被招募到內皮破壞部位的細胞,並導致粘附分子的表達和趨化因子的釋放,以招募先天免疫細胞。
在深靜脈血栓中,血小板在炎癥部位聚集,參與與嗜中性球和單核球的受體依賴性結合,並指導血小板與內皮細胞的交互作用,促進額外的免疫細胞募集。
總結
腸道菌群在人類健康各個方面的作用越來越被人們所認識。血栓形成是凝血系統、先天免疫系統和炎癥之間復雜的交互作用,腸道菌群在血栓栓塞的發生中也發揮著重要作用。
一些會增加血栓栓塞風險的疾病狀態與腸道菌群失衡有關,其特征是有益菌減少和致病菌豐度增加,其中最常見的是革蘭氏陰性的腸桿菌科的細菌。腸桿菌科細菌的增加會導致腸腔內LPS的產生增加。LPS透過受損的腸道上皮屏障轉運進入門靜脈,然後進入體迴圈。
細菌LPS正是腸道菌群失調與血栓形成之間的聯系之一。LPS啟用內皮細胞上的TLR4,導致促炎細胞因子的釋放以及懷布爾-帕拉德小體胞吐釋放凝血因子VIII和血管性血友病因子。LPS與血小板上的TLR結合,導致血小板活化,α-顆粒和致密顆粒的釋放以及細胞因子的釋放。TLR還透過與嗜中性球結合,增加嗜中性球胞外誘捕網的形成,調節血小板-嗜中性球的交互作用和免疫血栓形成,從而啟用凝血級聯反應。
腸道細菌也可以代謝飲食中的某些化合物,產生一些重要的代謝物。比如食物中的膽堿可以被腸道細菌的三甲胺裂解酶代謝為三甲胺,然後透過門靜脈迴圈進入肝臟,在那裏轉化為氧化三甲胺,並釋放到血液迴圈中。氧化三甲胺一旦進入體迴圈,會導致血小板高反應性,促進血栓形成,並與心血管疾病有關。
血栓栓塞事件是一個快速增長的臨床問題,癥狀因血栓的位置而異,嚴重者可危機生命,隨著時間的推移,它會變得更加危險。越早發現,越早尋求治療,就越有可能得到好的結果。預防也尤為重要,任何幹擾血液自由流動或正常凝血的因素都會增加患血栓的風險,包括許多疾病、藥物和生活方式因素。
腸道菌群在血栓形成中的作用對於最佳化治療和開發新的預防和治療策略至關重要。調節腸道菌群,特別是靶向LPS和氧化三甲胺水平,可能是降低血栓形成風險的一種創新方法。
圖片均來自網路
參考資料:
Hasan RA, Koh AY, Zia A. The gut microbiome and thromboembolism. Thromb Res. 2020 May;189:77-87. doi: 10.1016/j.thromres.2020.03.003. Epub 2020 Mar 6. PMID: 32192995; PMCID: PMC8780211.











