來源:藥渡
撰文:哥哈骎
1
抗生素或抗菌藥物
抗菌藥物(antibacterial drugs)來源於細菌、黴菌,或者透過化學的從頭合成(de novo synthesis)制備。從技術上講,「抗生素(antibiotics)」僅指那些源自細菌或黴菌的抗菌劑,但通常與「抗菌藥物(antibacterial drugs,或antibacterials)」同義使用。
抗生素有許多作用機制,包括:抑制細胞壁合成、增加細胞膜通透性、幹擾蛋白質合成、核酸代謝和其他代謝過程(如葉酸合成)(圖1)。
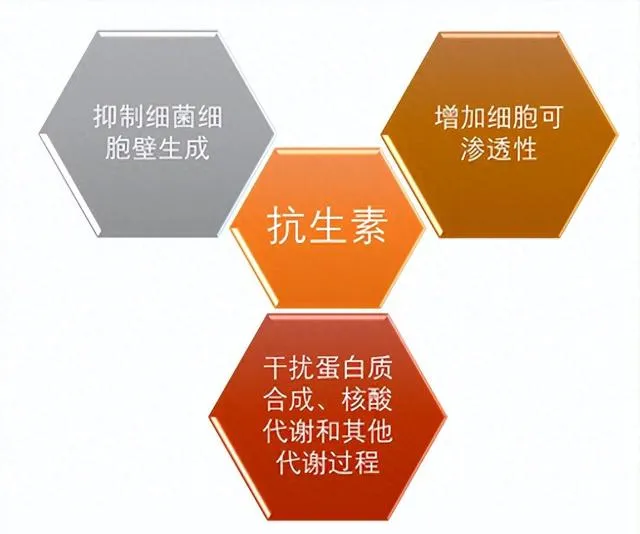
圖1. 抗生素常見的作用機制。
許多抗生素在化學上是相關的,因此可以分為幾類。盡管每一類藥物都具有結構和功能相似性(例如青黴素和頭孢黴素都含有β-內醯胺四元環),但它們通常具有不同的藥理學和活性譜。常見的抗生素大致可以分為以下幾類(圖2):
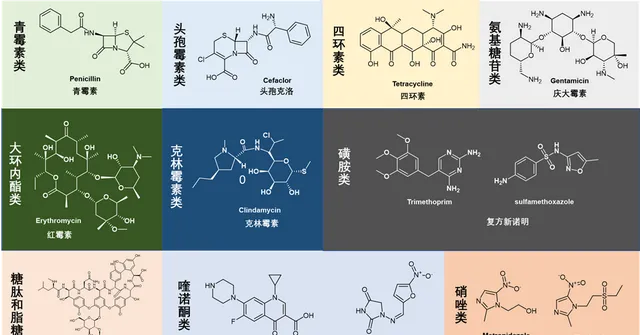
圖2. 常見抗生素類別與代表化學結構。
•青黴素類(Penicillins):包括苯氧甲基青黴素phenoxymethylpenicillin、氟氯西林flucloxacillin和安默西林amoxicillin等。
•頭孢菌素類(Cephalosporins):包括頭孢克洛cefaclor、頭孢羥氨芐cefadroxil和頭孢氨芐cefalexin等。
•四環素類(Tetracyclines):包括四環素tetracycline、脫氧羥四環黴素doxycycline和賴甲環素lymecycline等。
•胺基糖苷類(Aminoglycosides):包括慶大黴素gentamicin和妥布黴素tobramycin等。
•大環內酯類(Macrolides):包括紅黴素erythromycin、阿奇黴素azithromycin和克拉黴素clarithromycin。
•古連黴素類(Clindamycin)
•磺胺類(Sulfonamides)和甲氧芐啶(trimethoprim):例如復方新諾明co-trimoxazole。
•甲硝唑(Metronidazole)和替硝唑(tinidazole)。
•喹諾酮類(Quinolones):包括環丙沙星ciprofloxacin、左氧氟沙星levofloxacin和諾氟沙星norfloxacin。
•呋喃妥因(Nitrofurantoin)
•糖肽和脂糖肽(Glycopeptides and lipoglycopeptides):例如萬古黴素vancomycin。
這篇文章將重點介紹大環內酯類抗生素的內容。
2
大環內酯抗生素概念及紅黴素
大環內酯類藥物是處方最廣泛的抗菌藥物類別之一,對多種細菌具有活性。大環內酯類抗菌藥物自 1950 年代就已問世,並在那個時候證明在治療輕微和嚴重的細菌感染方面都非常成功。
所謂的大環內酯類抗生素,包含幾個關鍵詞:首先是「抗生素」,應該具有抗細菌的生物活性;其次是「內酯」,應該具有酯結構,而且是內酯,也就是說產生酯鍵的羧基和羥基來自於同一分子,即環狀酯;最後是「大環」,通常將八元環以上的內酯分子稱作大環內酯。大環可包含胺基氮、醯胺氮(但應與環肽區別)、噁唑環或噻唑環。苯環被排除在外,以區別於單寧。內醯胺也被排除在外(內醯胺抗生素如安沙美辛類Ansamycins)。
大環內酯類是一類天然產物,由一個大的大環內酯環組成,大多數大環內酯類藥物含有透過糖基鍵連線到內酯環的胺基糖和/或中性糖部份,通常是cladinose(紅黴糖)和desosamine(去氧糖胺),可以連線到該環上(圖3)。最常見的內酯環通常為 12、14、15 或 16 元。大環內酯類屬於聚酮類(Polyketide)天然產物。一些大環內酯具有抗生素或抗真菌活性並用作藥物。大環內酯類是抑菌劑,因為它們抑制或抑制細菌生長而不是完全殺死細菌。
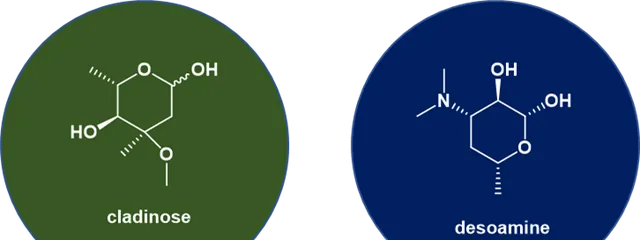
圖3. Cladinose(紅黴糖)與Desoamine(去氧糖胺)化學結構。
第一個獲得批準的大環內酯類藥物是紅黴素(Erythromycin,14元大環內酯,圖4),於1952年上市。紅黴素被廣泛用於治療各種感染,包括由革蘭氏陽性菌和革蘭氏陰性菌引起的感染。
它有多種給藥形式,包括靜脈內、局部和滴眼液。以紅黴素為活性物質的抗生素藥品包括Aktipak(中度痤瘡), Apo-Erythro-S(下呼吸道感染,例如肺炎、百日咳、白喉;性傳播感染,例如梅毒和衣原體;皮膚感染,包括痤瘡;上呼吸道感染,如鼻竇炎和咽炎), Benzamycin(尋常痤瘡), E.E.S.(多種細菌感染), Ery(軍團病、非淋球菌性尿道炎、性病性淋巴肉芽腫、百日咳等), Ery-tab, Eryc(多種細菌感染), Erygel(痤瘡), Eryped(多種細菌感染), Erythro(肺炎、皮膚病(痤瘡和酒渣鼻)、牙膿腫和性傳播感染), Erythrocin(多種細菌感染)等(圖5)。
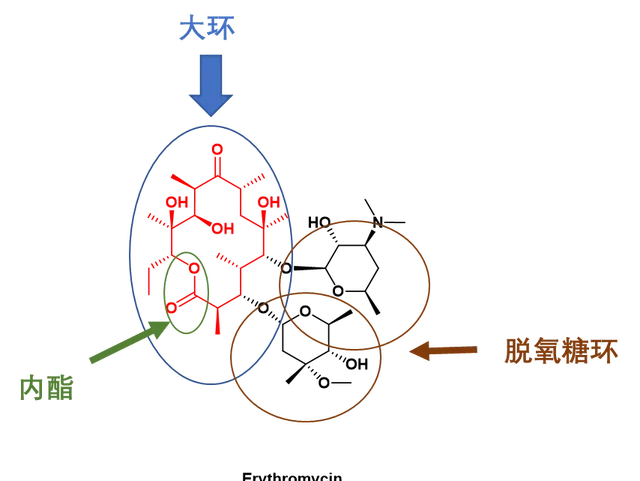
圖4. 第一個上市的大環內酯類抗生素紅黴素化學結構以及大環內酯特征域。
圖5. 以紅黴素為活性物質的藥物。
3
大環內酯抗生素作用機制
細菌為了復制,需要特定的蛋白質合成過程,這個過程由核糖體蛋白實作。 紅黴素的作用機制,從根本上說就是阻斷細菌的蛋白質生物合成過程,這種機制屬於抗生素抵抗細菌的三大武器之一(參見圖1)。具體來說,紅黴素透過結合50S核糖體亞基的23S 核糖體RNA來抑制蛋白質合成。它透過抑制蛋白質合成過程中的轉肽(transpeptidation)/易位(translocation)步驟,以及抑制 50S 核糖體亞基的組裝,來阻斷細菌蛋白質的生物合成, 從而中斷細菌對宿主的感染。包括紅黴素大環內酯類藥物對於細菌核糖體的強親和力,使它們具有廣譜抗菌活性的關鍵原因。
4
大環內酯抗生素發展歷程
一般來說,大環內酯類抗生素主要對革蘭氏陽性菌有活性,對革蘭氏陰性菌的活性有限。大環內酯類對葡萄球菌、鏈球菌和雙球菌革蘭氏陽性菌以及某些革蘭氏陰性球菌(如淋病奈瑟菌、流感嗜血桿菌、百日咳博德特氏菌和腦膜炎奈瑟菌)非常有效。此外,它們對各種黴漿菌也非常有效。由於它們與真核核糖體結合的親和力低,因此它們對真核生物的活性非常低。
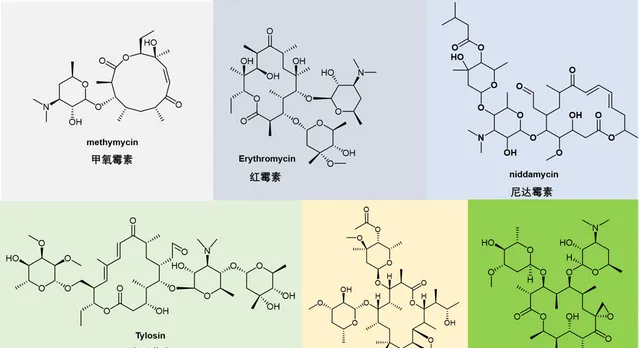
圖6. 第一代大環內酯抗生素化學結構。
盡管第一代大環內酯(圖6)類顯示出優異的抗菌活性,但它們普遍較差的生物利用度、不可預測的藥代動力學和在胃酸性 pH 值下的低穩定性。這促使人們早期尋找具有改進效能的新衍生物。這導致了第二代大環內酯類藥物的產生,它們是第一代天然產物的半合成衍生物。五種紅黴素衍化石相繼獲批上市:克拉黴素(Clarithromycin)、地紅黴素(dirithromycin)、羅紅黴素(roxithromycin)、氟紅黴素(flurithromycin)和阿奇黴素(Azithromycin)(圖 7)。其中克拉黴素和阿奇黴素在世界範圍內銷售量很大,而地紅黴素、氟紅黴素和羅紅黴素的銷售則沒有前兩者突出。屬於第二代大環內酯類抗生素的藥物還包括Miokamycin、羅他黴素(rokitamycin) 和氨基泰黴素 (Tilmicosin,獸藥)。
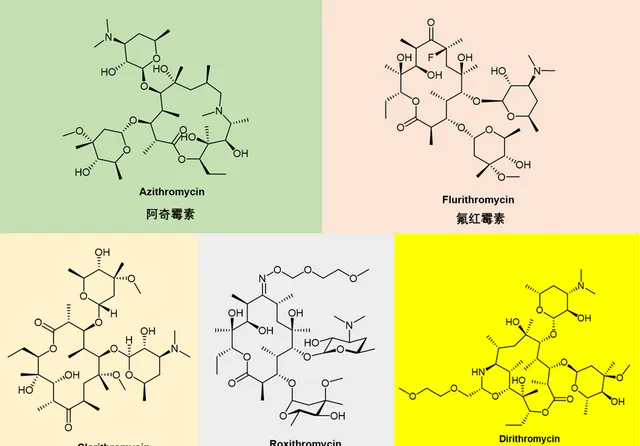
圖7. 第二代大環內酯類抗生素,紅黴素衍生物化學結構。
大環內酯類抗生素第二代衍生物均提高了口服生物利用度,並延長了血漿半衰期,使口服劑量減少至每天一次或兩次。由於相對於母體化合物紅黴素具有更高的親脂性,這些化合物還表現出增強的組織滲透性,因此對治療流感嗜血桿菌等細胞內病原體更有效。
然而相對於第一代大環內酯類抗生素,第二代化合物並未能夠提高對革蘭氏陽性菌的活性。它們之所以被選中進行開發,主要是因為它們增強了藥代動力學特性,特別是能夠在肺組織內積累到高水平。克拉黴素還與其他抗生素聯合使用,用於治療由幽門螺桿菌引起的胃潰瘍,以及由鳥分枝桿菌復合群引起的與愛滋病相關的呼吸道感染。
雖然第二代大環內酯類藥物在改善藥代動力學和耐酸性方面表現出了進步,但它們仍然面對抗生素的天字號挑戰:耐藥性。隨著大環內酯耐藥性問題愈發嚴峻 (耐藥性問題不僅針對大環內酯類抗生素,其它類別的抗生素同樣受到耐藥性的困擾),這促使研究者開發下一代大環內酯類藥物來對抗大環內酯類耐藥菌株。這一努力產生了第三代大環內酯類藥物,稱為酮內酯(ketolides),其中內酯環中的 3-酮基取代了紅黴素中存在的 紅黴糖cladinose。 此外,幾乎所有的酮內酯都包含一個稠合的 11,12-環胺基甲酸酯,以及一個連線到內酯環不同位置的烷基-芳基側鏈。第三代大環酮內酯類抗生素包括泰利黴素(Telithromycin)、喹紅黴素(Cethromycin)和索利黴素(Solithromycin)(圖8)。
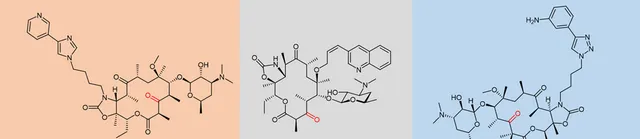
圖8. 第三代大環酮內酯類抗生素化學結構。
當今市場上唯一的第三代大環內酯是泰利黴素(Telithromycin,圖8),商品名為 Ketek®。它用於治療輕度至中度嚴重程度的社區獲得性肺炎(community-acquired pneumonia)。在出現重大安全問題後,美國食品和藥物管理局於 2007 年初大幅限制了該藥物的批準用途(酮內酯泰利黴素表現出罕見但嚴重的不可逆肝毒性,稱為「Ketek 效應」。這就是泰利黴素的使用受到限制並導致制藥公司專註於提高大環內酯類藥物安全性的原因)。另一種與泰利黴素具有相似活性的酮內酯類藥物喹紅黴素(cethromycin,圖8)在 2009 年被 FDA 拒絕批準。索利黴素(Solithromycin,圖8)目前正在進行 III 期臨床試驗,並且似乎是最有前途的酮內酯。
這些酮內酯對需氧性革蘭氏陽性菌具有出色的活性,包括耐大環內酯類肺炎鏈球菌菌株。 此外,它們對某些需氧性革蘭氏陰性菌(例如卡他莫拉氏菌和流感嗜血桿菌)表現出良好的活性。與被認為是時間依賴性殺菌劑的大環內酯類不同,酮內酯顯示出濃度依賴性殺滅作用。 除了上述三種酮內酯外,還開發了其他酮內酯化合物,但迄今為止沒有一種引起太多關註。
5
大環內酯抗生素抗藥性
大環內酯抗生素的抗藥性主要表現在抗生素藥物的親和力降低。這主要是透過兩大機制產生的:1)細菌核糖體或抗生素分子的被修飾;2)由於膜滲透性的改變或者外排泵表達,導致大環內酯類藥物從細菌細胞中流出。
外排蛋白主要屬於 Mef 和 Msr 家族;核糖體修飾機制包括核糖體 23S rRNA 或核糖體大亞基蛋白;藥物失活機制包括磷酸轉移酶對糖的 2'-羥基的磷酸化和大環內酯的酯酶水解(開環)。關於大環內酯抗生素耐藥性的深度閱讀,可以參見這方面的綜述文章。
6
大環內酯抗生素的臨床藥理學
討論大環內酯類藥物的臨床藥理學時,必須考慮以下因素:
•大環內酯類藥物與他汀類藥物(降膽固醇和低密度脂蛋白藥物)相互作用會增加肌病的風險。
•服用其他可延長 QT 間期(QT間期是描述心電圖波形中,Q波開始到T波結束的時間,該電位變化時間近似於從心室開始收縮到結束舒張的時間。QT間期過長或過短可能代表心律異常和心源性猝死的風險較高)的藥物(例如氟喹諾酮類、抗精神病藥、選擇性血清素再攝取抑制劑SSRIs、湯力和胺碘酮)的患者,應謹慎使用大環內酯類藥物。
•大環內酯類藥物會增加服用華法林(又稱Coumadin®,有助於防止血栓的形成)的患者出血的風險。
•與早期的大環內酯類藥物(如紅黴素)相比,後來的大環內酯類藥物(如克拉黴素)的不良反應較少。
•大環內酯類藥物通常與青黴素一起用於治療肺炎。大環內酯類涵蓋青黴素不起效的非典型生物,例如軍團菌和黴漿菌。
•大環內酯類藥物通常與其他抗菌藥物(如安默西林和奧美拉唑)一起用於治療幽門螺桿菌感染。
•對大環內酯類抗菌藥物有過敏史的患者不應使用大環內酯類藥物。大環內酯類抗菌藥物通常用作對青黴素過敏的患者的替代品。
•紅黴素具有促胃動力作用,這是其胃腸道副作用更為明顯的部份原因。
•大環內酯類藥物主要透過肝途徑清除。嚴重肝功能不全患者需慎用。腎功能不全患者可能需要減少劑量,因為少量大環內酯需要透過腎途徑清除。
•紅黴素和克拉黴素(但不包括阿奇黴素)抑制細胞色素P450 3A4酶 (CYP3A4),從而影響多種藥物的代謝。它們對 CYP3A4 的影響導致了對上述華法林和他汀類藥物的影響。
•紅黴素等大環內酯類藥物會被胃酸滅活,這意味著它們的口服制劑以腸溶劑或更穩定的酯的形式提供。
參考資料:
[1] Kanazawa, S. et al. The effects of grapefruit juice on the pharmacokinetics of erythromycin. Eur J Clin Pharmacol. 2001 , 56, 799-803.
[2] NIH StatPearls: Erythromycin
[3] Champney, W. S. et al. Macrolide antibiotics inhibit 50S ribosomal subunit assembly in Bacillus subtilis and Staphylococcus aureus. Antimicrob Agents Chemother. 1995, 39, 2141-2144.
[4] Champney, W. S. et al. Inhibition of 50S ribosomal subunit assembly in Haemophilus influenzae cells by azithromycin and erythromycin. Curr Microbiol. 2002, 44, 418-424.
[5] DA Approved Drug Products: Ery-Ped (erythromycin ethylsuccinate) granules for oral suspension.
[6] Dinos, G. P. The macrolide antibiotic renaissance. Br J Pharmacol. 2017, 174, 2967-2983.
[7] Böttger, E. C. et al. Structural basis for selectivity and toxicity of ribosomal antibiotics. EMBO Rep. 2001, 2, 318–323.
[8] Rodvold, K. A. Clinical pharmacokinetics of clarithromycin. Clin Pharmacokinet. 1999, 37, 385–398.
[9] Alvarez-Elcoro, S. et al. Antimicrobial macrolides in clinical practice. In: Omura S (ed). Macrolide Antibiotics, Chemistry, Biology and Practice, 2nd edn. Academic press: Orlando, FL, 2002, pp. 363–402.
[10] Hardy, D. J. et al. Clarithromycin, a unique macrolide. A pharmacokinetic, microbiological, and clinical overview. Diagn Microbiol Infect Dis. 1992, 15, 39–53.
[11] Haefner, M. et al. Clarithromycin, rifabutin and clofazimine for treatment of disseminated Mycobacterium avium complex disease in AIDS patients. Clin Drug Investig. 1999, 17, 171–178.
[12] Katz, L. et al. Translation and protein synthesis: macrolides. Chem Rev. 2005, 105, 499–528.
[13] Fernandes, P. et al. The solithromycin journey—it is all in the chemistry. Bioorg Med Chem. 2016, 24, 6420–6428
[14] Farrell, D. J. et al. Antimicrobial activity of solithromycin against serotyped macrolide-resistant Streptococcus pneumoniae isolates collected from U.S. medical centers in 2012. Antimicrob Agents Chemother. 2015, 59, 2432–2434.
[15] Woosley, L. N. et al. CEM-101 activity against Gram-positive organisms. Antimicrob Agents Chemother. 2010, 54, 2182–2187.
[16] Fyfe, C. et al. Resistance to macrolide antibiotics in public health pathogens. Cold Spring Harb Perspect Med. 2016, 6 pii: a025395.
[17] (a) Miklasińska-Majdanik, M. Mechanisms of Resistance to Macrolide Antibiotics among Staphylococcus aureus. Antibiotics 2021, 10, 1406; (b) Leclercq, R. Mechanisms of Resistance to Macrolides and Lincosamides: Nature of the Resistance Elements and Their Clinical Implications. Clinical Infectious Diseases, 2002, 34, 482–492; (c) Dinos, G. P. The macrolide antibiotic renaissance. British Journal of Pharmacology. 2017, 174, 2967–2983.
[18] Macrolides Pharmacology! Pharmafactz.com. 09, 11, 2020.
*聲明:本文僅是介紹醫藥疾病領域研究進展或簡述研究概況或分享醫藥相關訊息,並非也不會進行治療或診斷方案推薦,也不對相關投資構成任何建議。內容如有疏漏,歡迎溝通指出!











