合成生物聚合物是組織工程 (TE) 領域中替代受損組織的有效線索,可用於體外和體內套用。其中,聚左旋乳酸(PLLA)被認為是一種具有可調節機械效能和生物降解性的生物材料,可以透過各種方法制造具有不同微/納米結構的多孔支架。在這篇綜述中,我們討論了 PLLA 的結構、其主要特性以及克服其疏水性、合成性質的最新進展,這些特性限制了生物訊號傳導和蛋白質吸收。為此,可以對基於 PLLA 的支架進行表面改性或與其他生物材料(如天然或合成聚合物和生物陶瓷)結合使用。此外,還仔細研究了基於 PLLA 的支架的各種制造技術,例如相分離、靜電紡絲和 3D 打印,以及各種組織修復策略中采用的體外和體內套用。總的來說,本綜述重點介紹了 PLLA 在 TE 領域的特性和套用,最終深入了解了未來有效改善支架效能的方向和挑戰。

一、簡介
組織工程 (TE) 是一個多學科領域,涵蓋生命科學和工程學,旨在開發替代、修復和改善組織功能的生物替代品。支架與細胞和生長因子一起,在實作 TE 的目的中發揮著至關重要的作用。理想的支架應模擬天然細胞外基質 (ECM),這是一種包圍細胞並提供空間和機械訊號以協助細胞發育和形態發生的內源性物質。支架需要是可生物降解的材料,其降解必須與組織生長同步。因此,TE 的實際挑戰是制造具有足夠物理和生物特性的支架,以實作適當的細胞生長,同時確保體內環境的適當機械效能。在用於組織工程的可生物降解聚合物中,聚-l-乳酸 (PLLA) 因其有趣的機械效能和可客製的生物降解性而受到廣泛研究。因此,它可以在體外和體內套用中保持機械和結構完整性,同時支持組織形成。PLLA 屬於 PLA 家族,與 PDLA(透過 D-丙交酯聚合而成)相比,它具有更高的結晶性、化學穩定性和抗酶降解性,因此吸收時間更長。而且 PLLA 降解會產生對人體無害的 L-乳酸,而 PDLA 產生的 D-乳酸則危害較小。此外,PLLA 是采用生態可持續工藝合成的,不使用石油源或清潔不良的催化劑,並因其無細胞毒性而獲得 FDA 批準,這表明基於 PLLA 的支架可以有效促進組織再生。然而,PLLA 是一種聚酯,可以透過水解降解形成酸性副產物,從而改變局部 pH 值,從而損害植入支架的細胞分化。生化或物理過程可引起表面改性,從而影響 PLLA 的疏水性並改善細胞粘附和蛋白質吸附。透過將生長因子引入材料中可實作類似的反應,從而促進體外和體內的組織修復。組織工程取得了顯著進展,利用復合或混合系統開發出具有理想效能的支架。PLLA 通常與其他生物材料(如天然和合成聚合物以及無機材料)結合使用,超越了使用單一聚合物的極限。對於功能結構,目標是為組織提供足夠的結構和剛度以進行替換。有許多關於使用靜電紡絲、增材制造、顆粒浸出和相分離為各種組織工程套用制造 PLLA 支架的報道。
支架的另一個值得註意的套用是用作不同藥物負載的支撐材料,從而允許在所需時間內持續和控制藥物釋放。為此,人們研究了幾種工程系統,包括明膠、玉米醇溶蛋白、牛血清白蛋白 (BSA)、開菲朗和殼聚糖等天然材料,或聚己內酯 (PCL)、聚乳酸-乙醇酸共聚物 (PLGA) 和 PLA 等合成聚合物。這些治療套用需要較低的生物降解率,正如 PLLA 所觀察到的那樣。因此,它是延長藥物輸送系統的合適候選者。
科學文獻中有幾篇有趣的評論強調了 PLA 作為支架制造生物材料的用途,但對 PLLA 的同一主題的評論卻很少。由於 PLLA 是一種在組織工程中使用越來越廣泛的材料,因此對其基本特性的回顧將有助於為各種套用選擇這種材料。本綜述總結並討論了基於 PLLA 的支架的主要特性以及為提高這些系統的效能而提出的修改。本文還介紹了有關 PLLA 與其他生物材料相結合的混合支架制造和特性的文獻分析。此外,本文還仔細研究和討論了用於骨、軟骨、皮膚和血管替代的 PLLA 基支架。最後,提出了改進 PLLA 基支架的未來挑戰,以供新研究參考。
二、PLLA 作為生物材料
生物材料的組織工程套用廣泛集中在合成聚合物的研究上,因為它們具有有趣的機械強度、彈性和生物降解性。最近,PLLA 已成為組織工程領域大多數關註的焦點,用於制造在組織再生方面表現出高效能的純或混合支架。
2.1. PLLA 的結構
PLLA 是 PLA 家族的均聚物,該家族還包括均聚物 PDLA 和共聚物 PDLLA(圖 1)。該家族的誘人特性促使研究人員將研究重點放在這些聚合物上,因為它們無毒且具有出色的物理和機械效能。根據其成分和結構特性,PLA 是一種熱塑性脂肪族聚酯。它可能包括賦予材料特定效能的立體化學形式。例如,PLLA 和 PDLA 是半結晶聚合物,而 PDLLA 通常是無定形的。
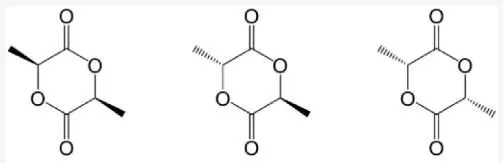
圖 1. 乳酸的對映體形式。
PLLA 代表了大多數 PLA 商業等級。它們是從 100% 天然資源(例如玉米澱粉和甘蔗)中獲得的環保型聚合物。其環境優勢既與非石油基工藝(即油、碳水化合物或植物的發酵工藝)的合成有關,也與使用生態可持續催化劑(例如七水合三氯化鈰和山梨糖醇)的可能性有關。PLLA 生產的優勢是能耗較低,因此成本較低。PLLA 由環狀二聚體丙交酯 LL- 組成,晶體結構在 30% 到 40% 之間,可具有多種形式(α、α'、β 和 γ);α 形式最穩定,因為它具有擬正交晶胞,其中 (10/3) 鏈采用螺旋構象。因此,兩側不對稱,導致晶格中鏈堆積的扭曲和排列鏈的能量穩定性。
2.2. PLLA 的生物學特性
PLLA 是一種經 FDA 批準的聚合物,與其他合成聚合物相比毒性較低。PLLA 的抗感染作用已在體內和體外實驗中得到證實,有助於修復受感染的組織。PLLA 相對於其他生物聚合物的顯著優勢之一在於 PLLA 在植入過程中的效能,確保了長時間再生過程所需的足夠機械效能。然而,研究人員對這種聚合物的疏水表面提出了一些質疑,這可能會損害其化石相容性,因為它會影響吸收的蛋白質素和細胞粘附。
在確定一種材料的生物學特性時必須考慮的另一個重要參數是其生物降解副產物,這些副產物在植入後會引起局部或全身毒性。在 PLLA 透過水解降解的過程中,聚合物會形成副產物乳酸,通常存在於體內並以水和二氧化碳的形式排出。3D 支撐物的最佳降解速率應與特定組織的 ECM 沈積速率相匹配。PLLA 降解的動力學取決於其部署後的結晶度、應變和微結構。結晶度越低、應變越大,降解速率越快。PLLA 被描述為具有緩慢降解動力學的可吸收合成聚合物。該特性由額外的甲基賦予,從而增加了疏水性和對水解的穩定性。PLLA 在體外和體內的降解時間分別約為 40 周和 30 周。
2.3. PLLA 的機械和物理特性
PLLA 因其可調的機械效能而在組織工程套用中得到廣泛探索。與其他合成聚合物(例如 PCL 和 PDLA)相比,用這種生物可吸收材料制成的支架通常具有更高的拉伸強度(60-70 MPa)和模量(2-4 Gpa),但斷裂伸長率較低(2-6%)。基於 PLLA 的支架已廣泛用於高強度組織(例如骨骼、韌帶和真皮),以在組織愈合期間提供物理支撐。然而,PLLA 的機械行為在很大程度上取決於其分子量、結晶度和老化特性。
2.4. 增強型 PLLA 基生物材料
改性聚合物材料的增強添加劑可以作為材料降解的觸發因素,並可以改善機械效能。增強型 PLLA 結構為改善支架效能提供了潛在的優勢。研究人員獲得並表征了一種用纖維素納米晶體增強的 PLLA 基納米復合材料。根據他們的研究結果,填料的存在增加了熔體流動的阻力和楊氏模量值。同樣,Mg(OH)2 也用於改善 PLLA 基復合材料的機械效能。另一種可以添加以獲得高效能 PLLA 基材料的材料是 BaTiO3,它專門用於賦予聚酯壓電效能。圖 2 顯示了 研究人員制造的用 BaTiO3 顆粒增強的 PLLA 纖維的整體和微觀結構。

圖 2. (d) 透過中試規模熔融紡絲獲得的用 BaTiO3 顆粒增強的初紡 PLLA 纖維,以及 (e) 初紡 PLLA/BaTiO3 纖維的 FE-SEM 影像。
其他添加劑也已用於改善細胞增殖和蛋白質吸收。其中,殼聚糖和羥基磷灰石已被證明可以增強 PLLA 基結構的骨活性。此外,PLLA 本身被發現是其他材料的增強劑。組織工程領域經常使用的天然聚合物缺乏良好的機械效能。膠原蛋白和明膠海綿以及絲纖維在用 PLLA 增強時具有更高的強度和彈性模量。
2.5. 藥物/生長因子負載 PLLA 系統
由於其生物降解率相對較低,PLLA 是延長藥物輸送系統的合適候選者。在這方面,研究人員開發了一種新的藥物載體材料,即由 PLLA 和利福平組成的混合顆粒,利福平是一種用作抗菌和抗真菌劑的抗生素藥物。采用冷凍幹燥技術制備混合顆粒,從由 PLLA、利福平糊 1,4-二氧六環組成的溶液開始。為了避免異質吸附法,作者認為利福平適合他們的研究,因為它可溶於 1,4-二氧六環和 PLLA。所得顆粒的平均孔隙率為 92±3%,比表面積為 10-40 m2 g-1(圖 3)。

圖 3. 透過滴液冷凍幹燥法制備的 PLLA/利福平混合顆粒表面和內部的 SEM 影像。(a) PLLA = 2.0 wt%,表面,(b) PLLA = 2.0 wt%,內部,(c) PLLA = 4.9 wt%,表面,(d) PLLA = 4.9 wt%,內部。
研究了利福平在水中的釋放動力學,結果取決於混合物顆粒的形態,可以透過改變原始溶液的濃度和冷凍加工參數進行調整。
研究人員評估了 PLLA/聚羥基丁酸酯 (PHB) 的藥物釋放能力。他們使用無溶劑熔融電紡絲和不同濃度的藥物雙嘧達莫 (DPD) 制備支架。作者發現 DPD 可作為 PLLA 的增塑劑,因此與純 PLLA 相比,它們可以在較低的溫度下進行熔融電紡絲過程。根據他們的研究結果,含有 DPD 的纖維比不含 DPD 的纖維表面更粗糙,單根纖維內的直徑也更不均勻。研究了不同 PLLA/PHB 比例(9/1 和 7/3)和相同藥物濃度(1%)下 DPD 的釋放曲線,結果表明 9:1 PLLA/PHB 系統比 7:3 系統更耐聚合物水解。與此結果一致,7:3 PLLA/PHB 纖維的擴散傳輸速率大約是 9:1 PLLA/PHB 纖維的兩倍。總體而言,作者證明了該混合系統增強藥物持續釋放的能力。
在最近的一項研究中,研究人員開發了一種新型 A-B-A 三嵌段共聚物,以 PLLA 為 A 嵌段,用於制備用於控制藥物輸送的微顆粒和納米顆粒。B 嵌段是聚(丁烯/三乙烯琥珀酸酯)P(BSTES) 共聚物體系,其中親水/疏水比和水解降解動力學透過控制嵌段長度進行調整,以實作藥物的充分釋放。為了研究這些新材料在制造用於控制藥物輸送的微顆粒和納米顆粒中的套用,評估了化學結構和分子結構以及顆粒大小對藥物釋放動力學的影響。具體來說,作者將地塞米松(一種具有快速胃腸道吸收的合成皮質類固醇)裝入微顆粒和納米顆粒中。從他們的研究結果來看,在生理條件下孵育 8 小時後,觀察到共聚物和純 PLLA 中的藥物釋放,共聚物中的藥物釋放已完全,而 PLLA 基質中的藥物釋放仍在繼續,盡管孵育過程中已有 80% 以上的藥物釋放。作者認為,在共聚物微粒中,藥物是透過擴散控制機制釋放的。相反,PLLA 微粒中藥物的釋放也受到後續階段發生的侵蝕過程的影響。
在 TE 領域,生長因子 (GF) 是一個基本要素,因為它們具有誘導和增強細胞反應的潛力。根據研究人員的說法,僅使用細胞和支架的組織再生通常不會成功,必須有外源性生長因子來啟動再生過程。在這種情況下,提出了結合生長因子的 PLLA 基支架來提高其生物活性並誘導細胞分化。研究人員透過靜電紡絲技術制備了載有富含血小板生長因子 (PRGF) 的絲素蛋白/聚 (L-丙交酯-e-己內酯) (SF/PLLA-CL) 血管移植物。加入 PRGF 以促進有效的平滑肌細胞 (SMC) 生長和滲透到移植物中。根據他們的研究結果,SF/PLLA-CL/PRGF 的應變 (282%) 和彈性模量 (1.8 MPa) 略高於 SF/PLLA-CL (分別為 259% 和 2.5 MP),與天然血管相比表現出適當的機械效能。關於細胞行為,PRGF 在很大程度上增強了細胞對移植物滲透並誘導快速 SMC 生長 (圖 4)。

圖 4. 在 SF/PLLA-CL/PRGF 和 SF/PLLA-CL 上生長 1、4 和 7 天的 SMC 的共聚焦激光影像。
在軟骨和骨 TE 中,研究人員引入聚(羥乙基)甲基丙烯酸酯 (PHEMA) 嵌段,將 GF 模擬肽結合到 PLLA 支架表面,並制造出具有改進生物活性的支架。分別結合兩種不同的 GF 模擬肽,即 TGF-β1 和 BMP-2,分別用於誘導 BMSC 的軟骨和成骨分化。在分子合成過程中調整共聚物中丙烯酸基團的密度以結合更多肽後,將這些肽引入 PLLA 支架中。根據報道的體外和體內測試,在 PLLA-PHEMA 支架中加入 GF 模擬肽可積極引導幹細胞沿著各自的分化途徑分化。與對照未結合支架相比,它們還促進了軟骨和礦化。
三、 用於組織工程的 PLLA 基支架加工
支架材料在提供功能支撐以增強細胞外基質沈積和細胞生長的同時,還暫時替代活組織的機械功能,起著至關重要的作用。在文獻中,許多研究工作都集中在 PLLA 上,無論是純材料還是復合結構,用於制備用作 TE 支架的多孔結構。
如圖 5 所示,可以采用幾種不同的方法來制造基於 PLLA 的支架,從而產生特定的孔隙形態。
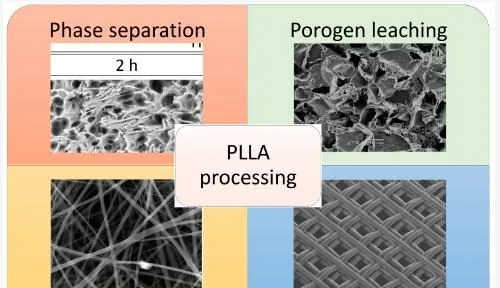
圖 5. 使用一些最常用的加工技術制備的基於 PLLA 的支架的孔隙形態。
表 1 列出了基於 PLLA 的支架制造可采用的主要制造方法及其加工參數、主要效能、優點和缺點。TIPS、DIPS、增材制造和致孔劑浸出方法允許人們獲得具有相對較高的機械效能的三維 PLLA 基支架,以滿足骨骼等硬組織的要求。另一方面,透過靜電紡絲生產的 PLLA 基支架通常是二維形狀或最終包裹在圓柱形收集器中以形成類似血管的結構。出於這個原因,結合這些系統的相對較低的彈性模量,PLLA 基電紡支架主要用於皮膚或血管再生。盡管文獻中提出的大多數基於溶液的加工都需要有機溶劑,但幾篇文章確保在研究時實作最終結構而沒有任何殘留溶劑痕跡,從而避免了細胞毒性。
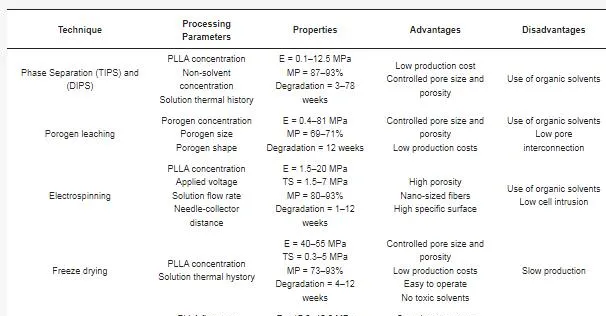
表 1. 用於生產 PLLA 基支架的制造技術。
四、純 PLLA 支架
PLLA 是一種可生物降解的、經 FDA 批準的聚合物。純 PLLA 支架因其可調的機械效能而被認為適用於組織工程目的,即 0.1 kPa–80 MPa 的壓縮模量取決於結構、孔徑和孔隙率(表 1)。這些特性使 PLLA 成為一種可行的材料,可以透過多種技術(例如增材制造、靜電紡絲、相分離和顆粒浸出)來制造,為組織再生提供充分的支持。研究人員使用超臨界二氧化碳 (SC-CO2) 凝膠幹燥並將該技術與致孔劑浸出相結合來生產 PLLA 支架,從而分別獲得納米多孔和微孔結構。他們的研究表明,生產的孔徑最大的支架可誘導人類間充質幹細胞 (hMCS) 的更高增殖。研究人員已經廣泛研究了透過相分離技術生產的 PLLA 支架。在研究 TIPS 和 DIPS 方法時,他們最佳化了操作參數,以獲得具有不同孔隙率和孔徑的多孔基質,足以容納各種類別的細胞。TIPS 技術還與糖樣版法相結合,生產 PLLA 基質,同時精確調節其多孔結構。透過相分離生產的 PLLA 支架的另一個主要特征是它們能夠控制其生物降解性。
靜電紡絲是生產用於組織工程的純 PLLA 支架的替代技術。靜電紡絲 PLLA 具有納米纖維結構,其孔隙率和厚度取決於聚合物溶液的初始濃度。靜電紡絲工藝可以制造用於傳感套用的 PLLA 支架,其中訊號監測和檢測動態觸覺刺激需要壓電特性。透過拉伸熱力學穩定的 α 晶型中隨機取向的 PLLA 鏈,電紡絲工藝可以將後者轉化為 β 晶型,其中分子鏈沿拉伸方向排列,從而產生極化和壓電效應。
研究人員已經證明,可以透過快速原型技術從 PLLA 粉末制造 3D 支架。然而,3D 打印的 PLLA 支架似乎表現出大尺寸的孔隙,無法支持細胞粘附。
4.1. 表面改性
盡管純 PLLA 支架已提供出色的效果,但其疏水性限制了細胞與材料的相互作用以及材料表面的生物辨識。表面處理可以提高 PLLA 的表面生物活性,從而為促進細胞粘附提供理想的環境。生物活性分子的沈積是最常用的表面處理方法。羥基磷灰石 (HA)、殼聚糖和膠原蛋白已被用作塗層,以改善 PLLA 基支架的生物特性。研究人員將單壁碳納米管 (SWCNT) 摻入電紡 PLLA 支架中。他們的研究表明,這種內含物賦予了排列整齊的納米級纖維基質導電性,促進了神經再生。在研究人員的研究中,臍帶血管周圍的組織華通氏膠 (WJ) 被用作 PLLA 電紡納米纖維的塗層。據作者稱,用 WJ 塗覆 PLLA 納米纖維對組織工程支架具有多種益處,因為 WJ 富含膠原蛋白、纖維和間質蛋白以及訊號分子。這些化合物可以促進細胞附著、增殖、浸潤和分化。事實上,WJ-PLLA 支架顯示出比組織培養板 (TCP) 和 PLLA 支架更高的人類間充質幹細胞 (MSC) 增殖。盡管如此,PLLA 支架的表面特性,如孔隙率和纖維直徑,並沒有受到 WJ 塗層的顯著影響。
在最近的一項研究中,生產了銀納米顆粒 (AgNP) 塗覆的 PLLA 膜 (PLLA@Ag)(圖 6),以賦予 PLLA 電紡支架抗菌效能。

圖 6. 不同樣品的 SEM 影像。聚(L-丙交酯)(PLLA)(A)、PLLA@PDA(B)、PLLA@Ag1(C)、PLLA@Ag3(D)、PLLA@Ag6(E)、PLLA@Ag9(F、G)和PLLA@Ag 24(H、I)。
改性後的PLLA膜表現出比純PLLA更優異的抗菌效能,具有巨大的臨床套用潛力。
另一種常用的改性聚酯表面的技術是等離子體處理。這種方法可以提高聚合物的親水性而不影響其本體性質。研究人員對靜電紡絲制備的PLLA支架進行了氧等離子體處理。根據他們的研究結果,等離子體處理降低了聚合物的接觸角並增加了表面自由能,導致極性成分發生變化,使PLLA更具親水性。因此,在等離子體處理過程中,應適當設定等離子體功率和處理時間等操作參數,以避免聚合物的生物降解性發生變化。
五、 PLLA 混合支架
雖然表面改性對細胞粘附和細胞相互作用有積極作用,但它們會改變表面的化學性質。這種現象會導致蛋白質吸收過多和不必要的化學反應,從而影響體內反應。因此,混合支架在克服與表面改性相關的問題的同時,還改善了純生物材料的效能。具體而言,PLLA 已與天然和合成聚合物以及陶瓷生物分子混合,以滿足所需的物理、機械和生物特性。此外,一些生物聚合物可能為細胞提供粘附位點,因此可以更好地模擬天然 ECM(見圖 7)。

圖 7. PLLA 基混合支架與天然聚合物、合成聚合物或無機生物材料結合的微觀結構。
5.1. PLLA/天然聚合物混合支架
天然聚合物已廣泛用於與合成聚合物的混合,因為它們的 ECM 狀結構可增強細胞在混合結構上的生長和粘附。組織工程套用方面有幾項研究旨在利用 PLLA 和天然聚合物(例如膠原蛋白、殼聚糖、絲素蛋白和明膠)制造混合支架。
(富臨塑膠供應:植入級可吸收PLLA聚合物、絲材)
明膠是一種源自膠原蛋白的分子,由於共價交聯,它在水溶液中很容易纏結成線圈。研究人員的研究表明,PLLA/明膠支架具有良好的機械效能和生物特性。他們的分級支架的核心是 PLLA,表面是明膠,這樣由於結構中的明膠分子,既保留了 PLLA 的機械強度,又增強了生物親和力。與膠原蛋白相比,明膠更易溶於水,在生理條件下提供更低的抗原和免疫原性反應,因此能更好地支持各種細胞譜系的分化。另一方面,研究人員觀察到,基於膠原蛋白的混合 PLLA 支架似乎比 PLLA-明膠混合支架更能促進細胞附著和增殖。事實上,明膠是部份變性的膠原蛋白,因此生物活性較低。然而,與膠原對照組相比,基於膠原的支架(如基於明膠的混合支架)在體內皮下植入後可產生更大的再生皮膚表面積。
最近,多糖對細胞附著的適用性已被利用來改善合成聚合物的生物學特性。在這些天然材料中,殼聚糖是一種在 TE 領域廣泛使用的天然多糖,具有獨特的抗菌效能。在研究人員的論文中,膠原蛋白和殼聚糖被用於增強 PLLA 支架的細胞活力。PLLA-殼聚糖-膠原支架是透過在不同濃度的殼聚糖(即 0.5% 和 0.6% 溶解在 10% PLLA 和 1% 膠原蛋白溶液中)下靜電紡絲制成的。這些支架因其高血液相容性(所有材料的溶血率均低於 5%,可安全直接接觸血液)和 1371 至 2593 mmHg 之間的爆破壓力而被發現適合模擬血管,與人體動脈爆破壓力(1264–3196 mmHg)一致。透過增加殼聚糖百分比,混合支架的拉伸強度增加,從而滿足血管移植材料機械效能的標準。
絲素蛋白(SF)是一種天然蛋白質,可以從多種蠕蟲中合成。絲素蛋白可以與合成聚合物結合,以增加它們的細胞親和力和粘附力。研究表明,絲素蛋白可以透過制備電紡 SF/PLLA 支架來改善 PLLA 的疏水行為。這項研究表明,纖維狀 SF/PLLA 結構具有出色的擴散性、軟骨細胞的 ECM 分泌和可調節的降解特性,因此是一種很有前途的軟骨 TE 材料。
5.2. PLLA/合成聚合物混合支架
使用天然聚合物的主要限制是其機械強度低和熱敏性高,這也會影響支架制造過程,例如使用靜電紡絲或增材制造時。當 3D 打印天然聚合物時,粘度可能會波動,因此很難制造具有精確結構的可重復支架。水環境中的天然聚合物在膨脹和塌陷時穩定性較差,導致孔隙之間的互連性降低。與天然聚合物支架相比,用合成材料開發的支架更容易制造,因為它們具有更多可調的特性,例如分子量、結晶度和轉變溫度。最近,合成混合支架被提出用於 TE,作為可完全控制機械效能和結構的材料。由 PLLA 和合成聚合物(例如 PCL、PLGA、PLA 和 PVA)組成的支架已專為 TE 套用而制造。
PCL 是一種脂肪族、半結晶、無毒聚酯,由於其橡膠狀態,通常用於增強支架的柔韌性。由 PLLA 和 PCL 組成的混合支架因其靈活的降解速率、最佳孔隙率以及良好的耐高溫高壓性而受到研究。研究人員研究了 50:50 PCL/PLLA 電紡支架在長達六個月的時間內體外降解。結晶度隨著時間的推移顯著增加,拉伸強度和重量也隨之減輕。PCL/PLLA 支架比純 PLLA 和 PCL 支架表現出活性水解和更高的剛度。利用電紡絲技術制造納米纖維 PCL/PLLA 支架,並進行檢查以評估其用於將人類誘導多能幹細胞 (hiPSC) 分化為胰島素產生細胞的可行性。體外研究顯示了有趣的細胞/支架相互作用,導致分化細胞的胰島樣簇的形成(圖8)。
圖 8. 三維電子顯微照片,包括(A)未接種的混合 PLLA/PCL 支架、(B)接種 hiPSC 的支架(起始日)、(C)誘導細胞組裝、(D)誘導細胞聚集和(E)胰島狀簇。比例尺為 (A):10 毫米;(B–E):100 毫米。
PVA 是另一種廣泛套用於 TE 的合成聚合物,因為它具有透明性、柔韌性和緩慢的降解動力學。由 PLLA 和 PVA 組成的支架已透過靜電紡絲技術制造,這是一種成功生產混合支架的簡單且經濟有效的方法。在研究人員的研究中。對電紡 PLLA/PVA 支架在人誘導性多能幹細胞 (iPSC) 的軟骨分化方面進行了研究。混合支架具有均勻光滑形態的纖維,並且與 2D 培養組相比,hiPSC 的活力和增殖率更高。此外,可以透過套用氧誘導等離子體處理來最佳化 PVA/PLLA 結構的表面親水性。
混合 PLLA/PLGA 支架在組織工程中顯示出良好的套用前景。PLGA 是 PGA 和 PLA 的共聚物,以其可調節的生物降解性而聞名,可以透過改變 PLA 和 PGA 的比例來控制。在研究人員進行的研究中,比較了純 PLLA 和 50:50 PLLA/PLGA 支架對體內骨形成的影響。盡管 PLLA 和 50:50 PLGA 支架具有相似的孔徑、孔隙率和表面體積比,但混合支架比純 PLLA 支架降解更快,骨長入率更高。另一方面,在整個研究期間,PLLA 支架的機械效能比 50:50 PLGA 支架更適合骨組織。透過在不同溶液濃度下冷凍幹燥制備了不同微觀結構的 PLLA/PLGA 支架,並對其進行了分析,以了解其微觀結構和機械效能如何影響成纖維細胞類別的行為 [150]。研究表明,當增加聚合物濃度時,支架的壓縮模量降低,拉伸模量增加,導致成纖維細胞在較低濃度的聚合物溶液中附著和增殖更好。
研究人員深入研究了含有 PLA 和 PLLA 共混物的支架。在這些研究中,透過相分離技術生產了具有不同 PLLA/PLA 比例的支架,並作為功能性多孔支架進行了測試。對設計的含有和不含有接種細胞的支架的體外降解率、孔隙形態和結晶度進行了評估。他們的結果表明,PLLA/PLA 混合支架的降解速度比純 PLLA 更快,並且在 PLA 百分比較高時機械強度較低。
此外,PLLA 已與多種聚合物結合以獲得適用於特定 TE 套用的最佳結構。其中,PLLA/殼聚糖/膠原蛋白結構、PLGA/PLLA/PDLLA 纖維和 PLLA-PEG-PLLA/PDLA 共混物被表征以評估其作為可生物降解材料的高效能。
5.3. PLLA/無機生物材料復合支架
在無機生物材料中,陶瓷材料因其高彈性和對礦化組織(如骨骼)的適用性而被用於組織工程套用。當單獨加工陶瓷時,由於其脆性,它們不能輕易地轉化為相互連線的多孔結構。透過將陶瓷和聚合物結合,可以生產出機械效能與承重組織相匹配的支架。在 TE 領域,最常見的生物陶瓷是羥基磷灰石、生物活性玻璃和磷酸鈣。它們是生物活性、化石相容性的材料,已被用作骨缺損修復的填料。因此,陶瓷材料可以與聚合物結合,因為它們既可以作為增強劑,也可以作為仿生線索,引導細胞分化,縮短礦化所需的時間。在合成聚合物中,PLLA 已成功用於制造具有可控宏觀和微觀結構的復合聚合物/陶瓷支架。
羥基磷灰石 (HA) 是一種類似於天然骨無機成分的骨傳導礦物。HA 的無毒性表明它可用於塗覆硬組織和金屬植入物。這種生物陶瓷可與 PLLA 結合形成具有最佳骨樣特性的復合支架。透過溶劑澆鑄技術制造的具有整合結構的 PLLA/HA 結構比純聚合物具有更好的熱穩定性和更高的分解溫度。HA 的高剛度使復合結構在比純 PLLA 更高的溫度下保持了機械穩定性。在 研究人員的研究中,對透過 TIPS 生產的 PLLA/HA 支架(HA 含量為 10% 和 20%)進行了骨組織植入檢查。形態學研究表明 HA 分布均勻,說明在 TIPS 過程中,即使在高 HA 濃度下也不會發生 HA 顆粒沈降。研究人員在復合 PLLA/HA 支架上進行了 MC3T3-E1 前成骨細胞的體外細胞培養。在他們的研究中,復合支架是透過 TIPS 技術在不同 PLLA/HA 比例或分層溫度下制造的(圖 9)。

圖 9. 在不同分層溫度下用 90/10 PLLA/HA 比例制備的支架的 SEM 顯微照片,分層時間保持不變。(A)25 ℃;(B)30 ℃;(C)35℃。
根據他們的研究結果,HA 不會影響支架的形態和活細胞數量。然而,PLLA/HA 支架在 21 天和 27 天時表現出比純 PLLA 結構更高的 ALP 活性。
生物玻璃 (BG) 或生物活性玻璃是一種化石相容性的磷酸鈣變體,用於骨療法以提高骨樣組織形成的速度。當使用生物玻璃時,由於這種材料的高表面反應率,當組織粘合時,疤痕組織的生長很少。生物玻璃透過增強細胞粘附和支架表面成骨細胞的增殖來提高支架的骨傳導性和生物學特性。近年來,45S5 生物活性玻璃(成分以重量百分比計:45% SiO2、24.5% Na2O、24.4% CaO 和 6% P2O5)作為聚合物支架塗層引起了廣泛關註,以刺激體內和體外新骨的形成。在細胞培養實驗中,結果表明BG/PLLA復合支架增強了MC3T3-E1細胞的堿性磷酸酶(ALP)活性和骨傳導基因表現,且具有含量依賴性行為。在體內動物實驗中,BG被證明有利於復合支架成骨能力的顯著提高。
除陶瓷外,其他無機材料也被用作基質填料來生產復合 PLLA 支架,盡管使用程度較低。最近,研究人員嘗試將氫氧化鎂納米顆粒 (nMH) 添加到 PLLA 基質中作為生物活性填料,透過中和 PLLA 降解引起的酸化環境來抑制炎癥反應。根據他們的研究結果,加入 nMH 可增強機械效能(例如楊氏模量)並減少水解降解過程中的體積侵蝕,從而降低細胞毒性和免疫原性。據作者稱,nMH 具有作為添加劑改善用於各種生物醫學套用(尤其是血管支架和骨科植入物)的可生物降解聚合物的機械和生物效能的巨大潛力。在另一項工作中,研究人員旨在制造用於神經組織工程目的的導電定向納米纖維基質。因此,他們將單壁碳納米管整合到 PLLA 納米纖維支架中,然後評估它們與用於治療神經損傷的嗅鞘神經膠質細胞 (OEC) 的細胞相容性。假設用導電化合物對 PLLA 納米纖維進行功能化可以幫助模仿神經組織的導電性質,作者成功證明 OEC 在這些支架上粘附和增殖良好,並沿著纖維方向排列(圖 10)。總體而言,SWCNT/PLLA 支架產生了一種潛在的結構,可以促進軸突生長和神經膠質從神經遷移到移植物,從而改善神經再生。
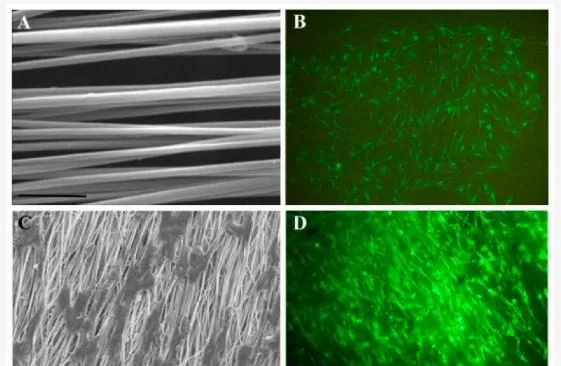
圖 10. 引導線索對 OEC 排列的影響。(A) 用作 OEC 基質的排列 SWCNT/PLLA 納米纖維,比例尺 = 10 µm;(B) 在培養板上生長的 OEC 呈現隨機取向,放大倍數為 100 倍;(C) 在納米纖維 SWCNT/PLLA 支架上排列的 OEC 的 SEM 顯微照片,比例尺 = 2 µm;(D) 在 SWCNT/PLLA 納米纖維支架上生長的排列 OEC 的熒光影像,放大倍數為 100 倍。
六、 PLLA 基支架在組織工程中的套用
PLLA 是首批被公認為組織工程有吸重力的材料的合成聚合物之一。在此背景下,PLLA 的特性已被客製以生產用於特定組織工程套用的 PLLA 基支架,包括骨骼、軟骨、血管和皮膚組織再生,如圖 11 所示。表 2 總結了為特定組織設計的 PLLA 基支架的材料組合、加工和特性。
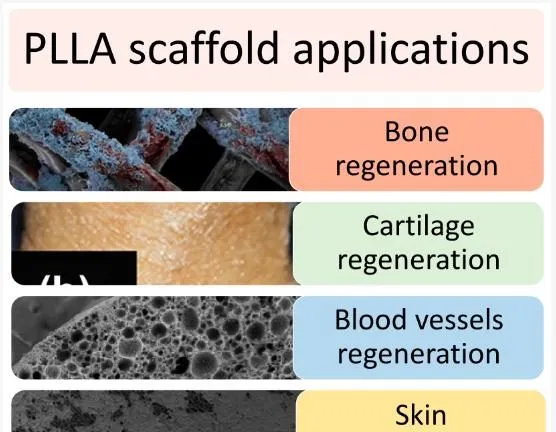
圖 11. 為骨骼、軟骨、血管和皮膚再生而設計的 PLLA 基支架結構。
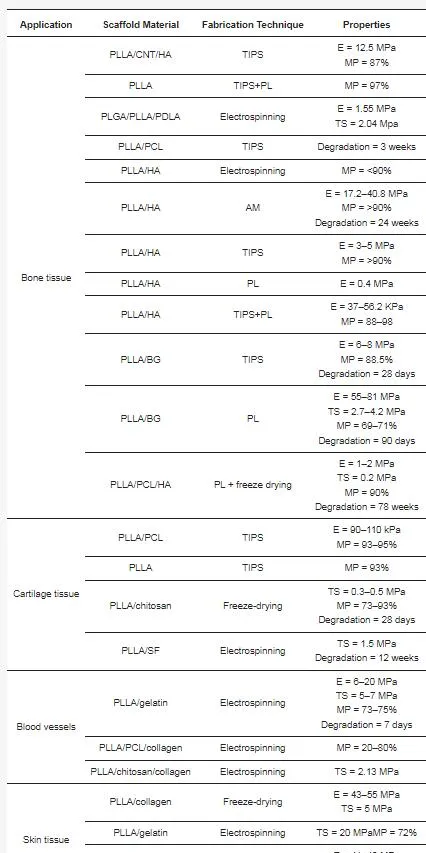
表 2. 為特定 TE 套用制造的 PLLA 基支架材料和特性摘要。
6.1. 骨組織
骨組織是一種動態而復雜的組織,由血管和不同的活性細胞組成,包括成骨細胞、破骨細胞和成骨細胞。根據微生物條件,未分化的成骨細胞可能變成成骨細胞或破骨細胞。透過這種方式,它們積極調節骨穩態。當出現小缺陷時,骨骼是一種自愈組織。然而,治療病理性骨折和復雜斷裂等嚴重缺陷仍然是一個巨大的挑戰。PLLA 基支架可以為骨組織修復提供功能支持。
研究人員在體外廣泛研究了透過相分離技術制備的 PLLA 基支架作為骨再生的潛在基質。他們分析了接種在 PLLA 基支架上的人類 MCS 的形態、生化和基因表現,包括單壁碳納米管、微羥基磷灰石顆粒 (HA) 和骨形態發生蛋白 2 (BMP2) 分子。他們的研究結果表明,在復合材料中添加 HA 和 BMP2 分別增加了支架上的細胞數量和礦化階段的膠原蛋白產生。另一方面,添加 SWCNT 的 PLLA 支架表現出較低的骨傳導能力。最近,對由 TIPS 生產的具有不同羥基磷灰石含量(10、25、50、75、90 wt.% 的 HA)的復合 PLLA/HA 泡沫的骨 TE 進行了深入分析。本研究表明,成骨細胞的壓縮效能和增殖率與泡沫的 HA 含量成正比,在 PLLA/HA 25/75 支架中達到最佳效能。使用相分離技術制造的基於 PLLA 的支架進行的體內研究表明它們適用於骨再生。研究人員比較了使用 PLLA 和 PLLA/PCL 支架對兔子 15 毫米尺骨缺損的體內再生。他們發現 PLLA 和 PLLA/PCL 支架的降解速度都很慢,骨礦物質密度也很低,而 PLLA/PCL 的骨痂形成優於 PLLA。事實上,PCL 不會產生酸性降解產物,因此抵消了 PLLA 的缺點。
在骨 TE 中,靜電紡絲已被廣泛用於生產結構接近骨納米級膠原纖維的納米纖維支架。電紡 PLLA 支架是使用表面修飾來生產的,可引導細胞分化為骨譜系並實作最佳的骨再生效能。透過成骨 ECM(由 MC3T3-E1 細胞分泌)的表面沈積,成功對電紡 PLLA 納米纖維進行了修飾。然後,使用這些支架檢查小鼠骨髓基質細胞 (mBMSCs) 對接種支架的反應。結果表明,與純 PLLA 納米纖維相比,改性結構的礦物質生長、ALP 活性和細胞形態處於最佳條件。
甚至使用臨界尺寸大鼠顱骨缺損模型檢查了電紡 PLLA/明膠納米纖維支架的體內骨形成情況。在這個方向上,從支架骨誘導性增加的角度分析了羥基磷灰石與納米纖維的結合。
植入後,PLLA/明膠支架顯示出比PLLA/明膠/HA支架更輕微的骨化,後者在前六周內誘導的骨再生速度更快。然而,經過十周的體內實驗後,沒有觀察到兩種類別支架之間存在顯著差異。
還透過增材制造技術生產了促進骨組織修復的功能性PLLA基支架,特別是與生物陶瓷材料結合。由於生物陶瓷的主要局限性在於它們無法在熱塑性聚合物存在下融合,因此已經開發出低溫沈積制造(LDM)來生產PLLA/陶瓷復合支架。所有這些支架都表現出高孔隙率和接近海綿狀人骨的機械強度,支持骨樣細胞增殖和體內骨傳導性。
6.2. 軟骨組織
軟骨是一種承重結締組織,包含軟骨細胞和周圍的細胞外基質,後者是由水、膠原蛋白、蛋白聚糖和其他非膠原蛋白組成的復雜網絡。逐漸衰老和受傷會導致軟骨損傷,從而導致骨關節炎等各種疾病。由於組織中缺乏祖細胞和血管形成,軟骨的自我修復能力極其有限。最近的組織工程生物技術已經研究了大量的支架結構和不同的 MSC 來源,以及合成聚合物和活細胞的組合,以構建可植入的軟骨再生替代品。合成聚合物和高模量水凝膠是組織工程軟骨最常用的支架材料。
例如,透過相分離結合致孔劑浸出制備的 PLLA 納米纖維支架已被證明是各種體內和體外軟骨修復策略的極佳候選材料。這一特征歸因於這些支架的高孔隙率和互連性,以及它們良好的可降解特性。研究人員透過 TIPS 技術制備了具有不同孔徑的 PLLA 納米纖維支架。然後,他們在體外和體內研究了孔徑大小與軟骨形成之間的關系(圖 12)。
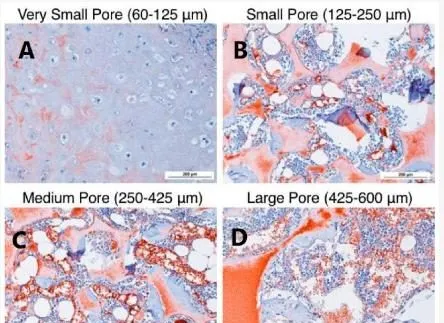
圖 12. 皮下植入 8 周後在 100 倍放大倍數下的 H&E 組織學分析。小孔支架(60-125 µm)(A)包含具有典型形態的軟骨,位於支架中心。小孔(125–250 µm)、(B)中孔(250–425 µm)、(C)大孔(425–600 µm)和(D)支架支撐的孔壁骨形成,骨基質呈粉紅色染色,孔內有骨髓樣組織。每組 N = 3。比例尺 = 200 μm。
結果表明,與大孔徑(425–600 µm)結構相比,小孔徑(125–250 µm)支架顯著誘導人 BMSCs 體外軟骨分化,更好地支持體內軟骨形成。
然而,盡管納米纖維 PLLA 基支架對軟骨修復具有有益作用,但其纖維性質導致承重效能有限。高度多孔的支架在機械效能和對軟骨 TE 的軟骨形成支持方面已得到廣泛研究。最近,研究人員透過靜電紡絲和 3D 打印制作了分層明膠/PLLA 支架,用於鼻軟骨重建。制作的支架在多孔 3D 打印 PLLA 支架表面具有納米纖維明膠膜。作者測試了多孔 3D 打印支架的內部結構對其機械效能的影響,結果最大拉伸強度為 18 MPa,與軟骨組織常見的 0.8-25 MPa 範圍一致。研究人員還研究了基於 PLLA 的海綿狀軟骨 TE 支架的機械效能。他們透過冷凍幹燥法制作了不同濃度的混合殼聚糖/PLLA 支架。根據他們的研究結果,隨著 PLLA 比例的增加,支架的機械效能會下降;然而,當殼聚糖與 PLLA 的比例為 70:30 時,支架達到了機械穩定性,這也顯示出對細胞增殖和附著的支持最為增強。研究人員還研究了多孔 PLLA 支架及其孔徑對軟骨細胞增殖和分化的影響。他們透過 TIPS 技術生產出孔徑可控的高多孔支架。從基因表現分析來看,平均孔徑為 100 µm 的支架似乎比孔徑為 200 µm 的 PLLA 更能促進軟骨形成基因的表達。關節軟骨和鼻中隔軟骨細胞都是如此。此外,還測試了這些支架的 MSCs 軟骨形成能力。結果顯示,孔徑為 100 µm 的支架中軟骨基因的表達更高。
所有提到的研究表明,支架孔徑的適當大小可以改善軟骨的功能特性,從而為這種組織的再生和修復提供有效的策略。
6.3. 血管
如今,臨床上治療動脈粥樣硬化引起的心臟病最常見的方法是血管旁路移植術。然而,這種手術只能繞過堵塞和受損的血管,而不能修復對心臟組織造成的損傷。因此,組織工程的重點是使用能夠類似於天然血管組織結構和功能的支架來建立血管網絡。動脈血管由三層結構組成:外層(外膜)由結締組織組成;中間層稱為中層,由平滑肌細胞和細胞外基質(膠原蛋白、彈性蛋白和蛋白聚糖)組成;內層稱為內膜,支撐單層內皮細胞。因此,生產這種復雜結構的功能替代品仍然是一個挑戰。傳統的血管 TE 研究已經研究了僅模擬三層血管中的一層的單層支架。使用 PLLA/PLGA/PCL 混合支架研究了用於血管組織工程的中膜重建(圖 13)。
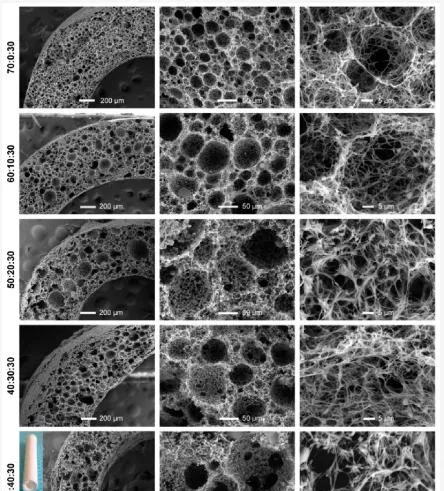
圖 13. 不同重量比的 PLLA/PLGA/PCL 復合支架的 SEM 影像和孔徑分布。
這些支架上接種了人血管平滑肌細胞 (HVSMC),並評估了細胞生長和浸潤能力。隨著培養時間的增加,HVSMC 逐漸在支架表面擴散並增殖。培養七天後,檢測到 HVSMC 浸潤到 PLLA/PLGA/PCL 支架內部,並強烈誘導標誌蛋白 α-平滑肌肌動蛋白 (α-SMA) 的表達。
最近,已經生產出了用於血管TE的多層支架。例如,PCL、膠原蛋白和 PLLA 納米纖維分別用於模擬內膜、中膜和外膜。為此,這些納米纖維透過連續電紡絲制成三層管狀支架。培養內皮細胞和平滑肌細胞以評估生物活性,結果表明中間層的膠原蛋白顯著改善了SMC的附著和增殖,內皮細胞增殖隨著培養而顯著增加,表明構建體無細胞毒性。
未來的研究方向應集中在植入更大的哺乳動物模型,例如犬或豬模型,以及使用患者自身細胞進行支架接種。
6.4. 皮膚組織
皮膚ECM由纖維蛋白、多糖、兩層致密組織層(即真皮和表皮)和細胞(主要是上皮細胞、角質形成細胞和成纖維細胞)組成。當皮膚受到嚴重損傷時,例如在暴露於高溫或高壓的情況下,它無法自我修復。由於可移植功能性皮膚供應不足,TE 領域已做出巨大努力,以開發有助於皮膚修復的工程化結構。在此背景下,已制造出基於 PLLA 的支架並與細胞一起使用以形成人體皮膚等效物。研究人員利用 PLLA 編織網的機械強度生產出具有漏鬥狀膠原蛋白或明膠海綿的混合支架。體外真皮成纖維細胞培養表明,與對照膠原海綿相比,混合支架誘導了高細胞接種效率並改善了成纖維細胞粘附和增殖。另一方面,體內傷口愈合評估表明,與對照膠原蛋白相比,混合支架中的愈合發生得更快、更有效。大多數情況下,PLLA、膠原蛋白和明膠經常結合在一起制造納米纖維支架,其物理特性和生物學特性與皮膚替代品中的物理特性和生物學特性相匹配。
PLLA 還被用於生產與天然皮膚結構非常相似的多層支架。研究人員開發了一種新型雙層支架,由表層殼聚糖/PCL 納米纖維墊(CP-nano 墊)和底層 PLLA 微孔盤(PLLA-microdisk)組成。在這項研究中,角質形成細胞和成纖維細胞分別作為表皮等效物和真皮等效物共培養。結果表明,雙層支架中的細胞增殖高於單個 CP-nano 墊和 PLLA-microdisk。此外,基因和蛋白質表達評估表明傷口愈合活躍,再次證實雙層支架可以提供刺激皮膚再生的合適微環境。應開展進一步研究以生成符合臨床套用要求的三維組織。
七、結論和未來挑戰
用於組織工程套用的生物材料應具有足夠的機械效能和易於加工的適應力。PLLA 是一種具有這些先決條件的合成聚合物,並且基於 PLLA 的支架已被證明能夠在體外和體內促進組織向內生長和功能替代品的開發。PLLA 是一種生態聚合物,因為它是使用綠色溶劑和催化劑合成的。盡管如此,在 TE 中使用 PLLA 解決了一些與酸性副產物的釋放及其積累有關的挑戰,這些副產物會產生炎癥,對組織再生產生負面影響。同樣,人們也進行了許多嘗試來增加這種聚合物的表面親水性,然後改善細胞的粘附性和蛋白質的吸收。在這篇綜述中,我們描述了為克服這些問題而采用的各種策略,例如表面改性和使用由 PLLA 和生物活性材料制成的復合結構。PLLA 是一種很有前途的軟組織和硬組織修復生物材料,因為它的降解速度相對較慢,並且透過與其他聚合物混合或與無機填料結合而具有可調的機械效能。據報道,PLLA 基支架制造有不同的制造技術,例如靜電紡絲、相分離、鹽浸出和增材制造,可在宏觀和微觀尺度上產生各種幾何形狀和形態的結構。從這篇文章可以看出,PLLA 是一種可生物降解的合成聚合物,在組織工程的體外和體內模型中發揮著重要作用,本文還研究了 PLLA 基支架在生物醫學領域的最新進展。
盡管 PLLA 在人造組織方面表現出巨大的潛力,但其臨床套用仍然有限。未來,應該透過進行更多的體內研究和臨床試驗來評估基於 PLLA 的工程構建體的臨床適用性。具有體外功能特性的支架可能會在體內產生不良影響,因為體內包括在組織修復階段動態變化的所有生物和物理刺激。因此,在構建組織支持以更好地模擬天然組織之前,應考慮各種機械和化學因素以及細胞增殖過程中支架特性的變化。此外,PLLA 材料的機械效能和降解行為受其結晶度的影響,這與支架制造技術有關。研究人員必須考慮支架制造過程中的所有技術參數,以改善支架的效能。最後,應該對 PLLA 基支架內藥物或抗生素的負載進行更多的研究,以治療相關感染並評估植入物的藥效學和藥代動力學行為。
東莞市富臨塑膠原料有限公司供應:PLLA左旋聚乳酸、植入級可吸收聚合物、單絲、復絲
公司地址:廣東省東莞市樟木頭鎮塑金國際1號樓810











