编者按: 严冬十二月,积雪亘千古。 本期【文献荐读】栏目由肺癌主编中国医学科学院肿瘤医院胡兴胜教授进行肺癌领域的相关文献荐读。医者「胜」也,共赴一场思想之约。
专家简介

胡兴胜 教授
中国医学科学院肿瘤医院内科主任医师、硕士生导师
中国医药教育协会肿瘤化疗专业委员会副主委/秘书长
中国医疗保健国际交流促进会肿瘤内科分会常委
中国老年肿瘤学会微生物专业委员会常委
中国中医药研究促进会肿瘤专业委员会常委

史慧洋
北京协和医学院2022级硕士研究生
研究方向:胸部肿瘤的化疗、靶向治疗、免疫治疗等。
01
研究背景
靶向治疗的获得性耐药仍然是个尚未解决的临床问题。虽然已经确定了许多获得性耐药的驱动突变,但治疗期间肿瘤进化的潜在分子机制尚不完全清楚。患者肿瘤基因组分析提示载脂蛋白B信使RNA编辑催化多肽样(APOBEC)胞苷脱氨酶参与肿瘤进化。然而,它与疗效和获得性耐药的关系尚不明确。APOBEC可催化胞苷脱氨水解为尿苷,导致基因组中TpC基序上的C→T或C→G。由APOBEC引起的突变已经在数十种癌症中被发现,且几个APOBEC家族成员与肿瘤的发生发展密切相关。之前的研究表明,一些病例中预先存在的耐药克隆可能在治疗选择压力下占主导地位,然而在另一些病例中,癌细胞可能产生短暂的中间状态——耐药持久性细胞(DTPs),从而产生适应和进化。
02
研究方法及结果
一
APOBEC突变与克隆进化
酪氨酸激酶抑制剂(TKIs)治疗的NSCLC患者可通过耐药克隆的线性进化逐步获得耐药突变。作者利用非负矩阵分解(NMF)对1例含有复合耐药ALK突变的NSCLC患者的不同克隆在序贯TKI治疗期间的突变过程进行分析,发现多数新突变涉及TpC基序上的C→T和C→G的替换,这与APOBEC胞苷脱氨酶活性相关,称之为「APOBEC突变」。有趣的是,每个获得性耐药的ALK突变均为APOBEC突变。此外,7个TKI耐药细胞系的基因组测序(WGS)观察到不同程度的APOBEC突变。在吉非替尼耐药细胞系中,与GR2细胞(预先存在EGFRT790M)相比,GR3细胞(获得性EGFRT790M) APOBEC突变富集。PC9克隆的WGS结果也提示晚期耐药克隆(来自耐药持久性细胞)单核苷酸变异(SNV)数量和APOBEC突变明显高于早期耐药克隆(预先存在EGFRT790M突变)。上述结果均表明APOBEC突变富集与TKI治疗期间DTP的进化有关。
随后,作者构建了PC9单细胞克隆库和异质种群,用吉非替尼处理三个复制池,直至出现一个完全耐药克隆。发现耐药克隆与敏感克隆基线APOBEC突变频率没有明显差异,表明APOBEC突变是受治疗诱导产生的,基线APOBEC突变负荷并不影响DTP的克隆选择。
二
靶向治疗可诱导APOBEC3A
在11种APOBEC中,A3A和A3B都与人类癌症相关。之前的研究表明经典APOBEC突变可能由 A3A、A3B或两者共同引起。虽然A3B常高表达,但A3A是一个更强大的突变体,它在体内具有更强的致癌能力,并在细胞系中主导APOBEC突变。RNA测序数据集(RNA-seq)提示TKI治疗期间A3A表达增加。作者利用数字PCR区分A3A和A3B活性,发现TKI治疗开始后,EGFR突变NSCLC细胞系DDOST mRNA A3A发卡基序上的C→U编辑短暂升高,14天后在DTP中持续存在。在小鼠体内,用奥希替尼治疗EGFR突变的NSCLC细胞系异种移植物(CLX)或患者来源的异种移植物(PDX)直至其恢复至稳定的微小残留病灶(MRD)状态后,发现TKI治疗后残留肿瘤的DDOST mRNA编辑较未治疗组更高。此外,ALK融合抑制剂、KRASG12C和MEK抑制剂具有类似的作用,表明A3A的诱导是肺癌细胞在接受靶向治疗时的常见反应。作者使用一或三代TKIs和MEK/PI3K抑制剂分别处理初治和EGFRT790M耐药的NSCLC细胞系,发现A3A仅在EGFR和/或下游MEK-ERK信号通路被抑制时才被诱导,表明A3A激活与致癌信号受抑制相关。
三
APOBEC3A增加耐药持久性细胞(DTPs)的基因组不稳定性
为了探索DTP细胞A3A突变与靶向治疗的因果关系,作者构建了A3A缺陷克隆(KO) 和对照(SCR)PC9克隆,并在免疫缺陷小鼠中构建移植瘤,用奥希替尼治疗22周。除了两个SCR肿瘤复发之外,A3A KO和SCR肿瘤对奥希替尼治疗均表现为消退并保持稳定的MRD状态。采集治疗22周后的MRD并构建单细胞克隆,WGS显示治疗期间总SNVs和APOBEC突变在SCR肿瘤中增加,而在A3A KO肿瘤中显著减少,且A3A KO肿瘤中不存在Kataegis突变和弥散性超突变簇。体外劳拉替尼处理ALK融合阳性p122 DTPs细胞系的WGS提示APOBEC突变在SCR克隆中富集,在A3A KO克隆中减少,而在没有劳拉替尼处理的SCR克隆中几乎没有观察到APOBEC突变。以上结果均表明TKI可诱导A3A,从而导致DTPs中APOBEC突变积累。
在PC9细胞系中,与A3A KO MRD肿瘤相比,SCR的SVs(如易位、倒置和大片段插入/缺失)发生率明显更高。DNA损伤反应标记物γpAX的免疫荧光在部分G2/M期持久性细胞中显著增加。此外,TKI处理的DTP细胞和未经TKI处理的A3A过表达细胞均存在双链断裂(DSB)积累,而A3A敲除后的PC9 和p122细胞中TKI诱导的DSBs减少。以上结果表明TKI诱导的A3A会促进DTP细胞DNA损伤,这也解释了TKI处理细胞中的染色体畸变现象。(下图)
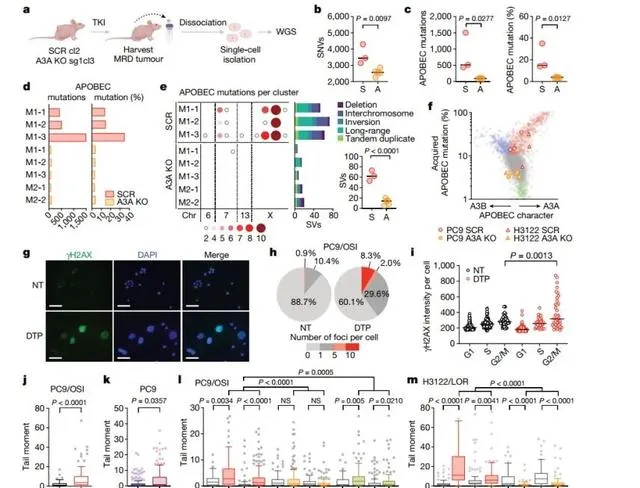
四
APOBEC3A促进DTPs的出现
在评估A3A对耐药克隆进化的影响时,作者构建了A3A过表达的PC9、MGp19-1和p122细胞系。多西环素诱导的野生型A3A异常表达增大了DTP克隆群落。相反,shRNA敲低或A3A敲除可抑制DTP群落的出现,而在A3A敲除的PC9细胞中重新表达野生型A3A可恢复其在奥希替尼处理下DTP群落的形成。此外,作者对多个A3A KO和SCR克隆的竞争实验表明TKI处理后SCR克隆产生了大量DTPs,而A3A KO克隆几乎完全没有DTPs,提示TKI诱导的A3A对DTPs群落的形成至关重要。最后,作者研究了TKI长期治疗对A3A缺失耐药克隆的影响,发现治疗12周后A3A缺失的PC9细胞中耐药克隆显著减少。因此,TKI诱导的A3A促进了耐药持久性细胞的存活和耐药克隆出现。(下图)
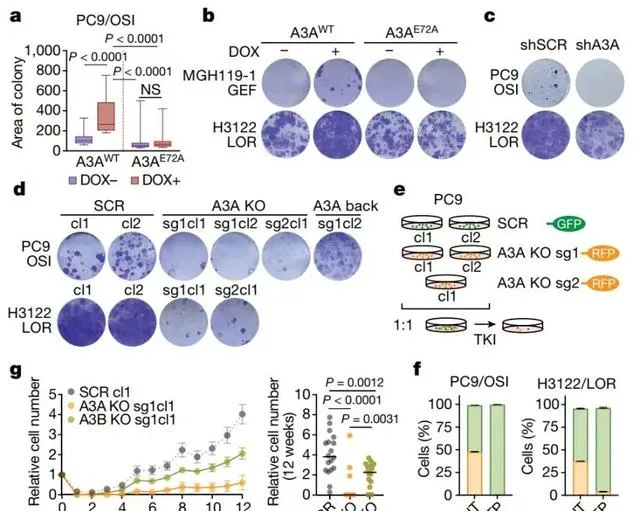
03
结论
该研究报道了肺癌靶向治疗诱导的胞苷脱氨酶APOBEC3A (A3A) 可促进双链DNA断裂,增加基因组不稳定性并驱动DTPs进化,从而导致治疗期间耐药细胞突变。A3A的缺失减少了持久性细胞的APOBEC突变和结构变异,延缓了耐药的发生。此外,APOBEC突变特征在靶向治疗产生持久疗效后进展的肺癌患者中富集。总之,靶向治疗诱导的A3A驱动耐药持久性细胞进化,这表明抑制A3A的表达或活性可能是预防或延缓肺癌靶向治疗获得性耐药的潜在治疗策略。
主编评语
该研究证明临床肺癌靶向治疗可以诱导A3A的表达,从而促进耐药持久性细胞的进化。多数接受靶向治疗的NSCLC患者(尤其是长时间和多线TKI治疗的患者)存在APOBEC突变富集。这种APOBEC获得性突变可能代表了耐药克隆的进化途径。该研究表明,对致癌信号的抑制可以诱导APOBEC驱动突变,即靶向治疗可能会反常地增加癌细胞的适应性突变。
尽管该研究支持A3A在这个过程中起主导作用,但其他一些APOBEC家族成员也在实验模型中共表达,也可能促进靶向治疗过程中肿瘤的进化。研究发现,在TKI治疗期间A3B的缺失抑制了部分DTPs的出现,因此其他APOBEC蛋白在肿瘤进化中可能与A3A产生协同作用。多数NSCLC治疗后样本的A3A常见位点YTCA和茎环发夹基序中存在APOBEC突变富集。越来越多的证据表明部分肿瘤类型(如乳腺癌、肺腺癌、肺鳞癌、黑色素瘤和头颈鳞癌)中弥散型超突变与A3A相关。该研究也观察到TKI处理的细胞和小鼠移植肿瘤中小簇APOBEC突变累积,支持 A3A在NSCLC靶向治疗期间促进肿瘤进化。
该研究描述了一例ALK融合阳性非小细胞肺癌产生的经典APOBEC突变基序上的多重抗性突变。然而,临床上最常见的EGFR和ALK获得性耐药突变(如EGFRT790M、EGFRC797S和ALKG1202R)是由APOBECs常见核苷酸序列之外的碱基替换造成,不太可能直接由APOBEC突变引起。此外,作者在mRNA转录本中检测到的多数A3A相关RNA编辑都是同义替换,不会改变蛋白质序列。对PC9早/晚期耐药克隆以及具有治疗前后配对样本的15例患者中获得性驱动突变分析发现已知的APOBEC驱动突变(PIK3CA, PIK3CB, CTNNB1, KLF5, NFE2L2和ALK)仅存在于在部分患者中。其他患者和模型没有明确可能的驱动因素,表明 APOBEC3A并不会在所有病例中驱动复发性耐药突变产生。此外,该研究注意到TKI治疗后肿瘤中A3A表达和APOBEC突变积累并不是普遍存在的,这表明治疗诱导APOBEC突变的其他机制仍需进一步探索。一项一线奥希替尼治疗后进展的EGFR突变肺癌的研究报告提示仅部分患者的APOBEC突变频率增加,这也证实了上述观点。
该研究表明抑制A3A可作为一种预防或延缓肺癌靶向治疗获得性耐药的潜在治疗策略,但迄今为止还没有报道过相关高效或高选择性的小分子。虽然已经发现NF-κB是TKI诱导A3A表达的关键转录因子,但最适合靶向治疗的上游节点仍需进一步确定。总之,该研究提出了一种驱动靶向治疗耐药的新机制,为后续进一步开发靶向非小细胞肺癌APOBEC3A的治疗策略提供了理论依据。
医悦汇月度关注榜
2023年11月,看看你上榜了吗?

版权声明
本文版权归医悦汇所有。欢迎转发分享,其他任何媒体如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明「转自:医悦汇」。












