你敢相信吗?从粪便中提取出具有强烈粪臭味的物质,当用酒精稀释上千倍后,脱胎换骨变成了一种香味。这就是一种 吲哚衍生物 ——3-甲基吲哚(又名粪臭素)
吲哚 ,是所有花香类原精的关键成分,这种物质在低剂量1-3%浓度时,具有放松的作用,协同苯基酯,能强效 抗痉挛 , 增添感官愉悦 和魅力。然而,如果简单将吲哚等同于香水,未免太少看它的功效。
在谷禾特定肠道菌群检测报告中 炎症 部分或 毒素 部分有 吲哚 这个指标。
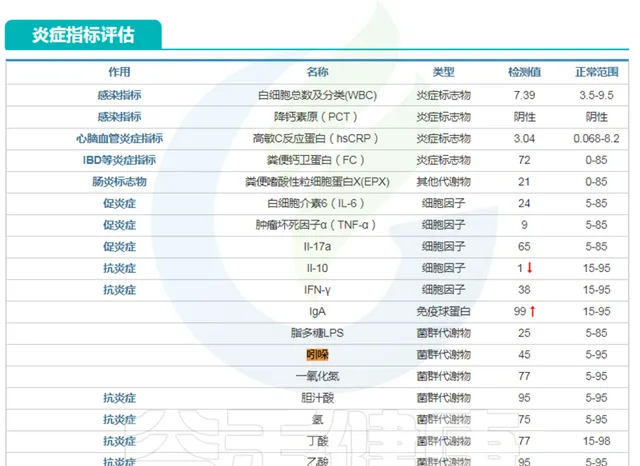
<来源:谷禾肠道菌群检测数据库>

<来源:谷禾肠道菌群检测数据库>
很多人可能对与菌群和健康相关的血清素,色氨酸,脂多糖,组胺等指标比较熟悉,但是对吲哚还是比较陌生,实际上 吲哚 与 肠道微生物群 和 人类健康 和生活关系密切,例如,吲哚衍生物可以影响 胃肠道的蠕动 ,可能会 影响便秘或腹泻 等状况;吲哚及其衍生物已被证明可以 加强肠道屏障功能 ,有助于 防止 病原体和有害物质进入血液。
事实上,由吲哚衍生而来的各种化学物质,对人体 神经调节 和 抗病原微生物 ,有 极为积极 的作用。在人体中存在着许多这样神奇的吲哚类物质。内源性吲哚及其衍生物是源自肠道微生物群的 色氨酸代谢物 ,具有 一系列生物活性 。
最近的研究表明,吲哚有助于 维持人体肠道的生物屏障 ,主要通过 激活 AhR和PXR受体来发挥 抗炎活性 ,从而影响免疫系统的功能, 显著改善肠道健康 (炎症性肠病、出血性结肠炎、癌症结直肠癌),并进一步 促进人类健康 (糖尿病、中枢系统炎症和血管调节)。
作为 细胞间信号分子 ,吲哚还控制细菌生理学的各个方面,例如产吲哚细菌的 孢子形成 、质粒稳定性、 耐药性 、生物膜形成和 毒力 。相比之下,许多不产生吲哚的细菌、植物和动物产生多种加氧酶,可能会 干扰吲哚信号传导 。
吲哚还是身体 神经系统 与 内分泌系统正常与否 的风向标。所谓的 体臭 ,其实就是人体内 吲哚含量增高 的表现。吲哚在 细菌生理学 、 生态平衡 以及 人体健康 中发挥着重要作用。
然而,吲哚的毒性影响也不容忽视。过量的吲哚会对 情绪和行为 产生不利影响,硫酸吲哚酚是一种吲哚衍生物,具有 肾毒性 和 心血管毒性 。 羟吲哚 还可能 降低神经元兴奋性 。
吲哚 与 肠道微生物群 之间的相互作用以及吲哚对 人类健康 的影响是一把 双刃剑 。本文主要讲述了 内源性吲哚的生物合成 、吲哚对 肠道功能 及 微生物群 的影响,为吲哚与 疾病的相关性 提供了科学依据。
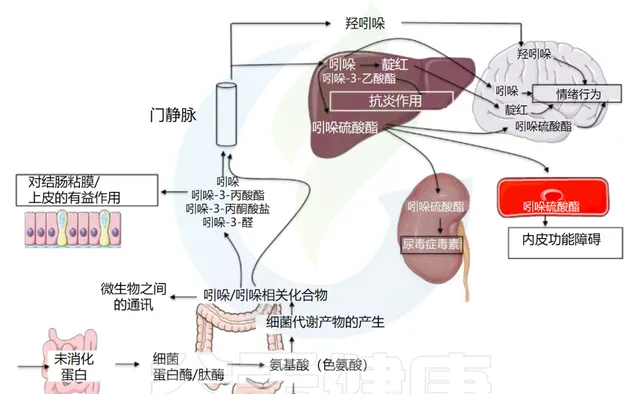
Tennoune N,et al., Microorganisms.2022
内源性吲哚的生物合成
吲哚(Indole)是一种有机化合物,是吡咯与苯并联的化合物,又称 苯并吡咯 。吲哚及其同系物和衍生物 广泛存在于自然界 ,主要存在于天然花油,如 茉莉花 、苦橙花、 水仙花 、香罗兰等。
而 内源性吲哚 及其衍生物是来源于肠道菌群的 色氨酸代谢物 ,具有一系列 生物活性 。内源性吲哚类物质包括吲哚本身以及吲哚的 代谢产物 ,如吲哚-3-甲酸、吲哚-3-丙酸、硫酸吲哚酚等。
吲哚相关化合物的结构
Lee JH, Lee J.FEMS Microbiol Rev.2010
肠道菌群产生吲哚类物质
细菌蛋白酶和肽酶从可用的 膳食 中释放氨基酸,包括色氨酸。而 色氨酸 是吲哚的主要前体。大部分色氨酸在小肠中被吸收,约 4%~6% 的色氨酸在结肠中被 肠道菌群分解代谢为吲哚 。
色氨酸作为一种必需氨基酸,主要从富含蛋白质的食物中获取,是 唯一含有吲哚的氨基酸 。
肠道中的色氨酸通过三个主要途径进行代谢:1) 犬尿氨酸途径(摄入的色氨酸的95%);2)细菌色氨酸代谢(4-6%);
3) 血清素途径 (1-2%)
✦ 肠道菌群主要通过色氨酸酶将色氨酸转化为吲哚
肠道细菌主要通过 色氨酸酶(TnaA) 的作用将 色氨酸转化为吲哚 ;色氨酸酶TnaA可逆地将 色氨酸 降解为 吲哚 、 丙酮酸 和 氨 。
值得注意的是,在哺乳动物中,吲哚完全来源于 细菌代谢活动 ,因为 宿主细胞不具有 产生这种化合物的代谢能力。
色氨酸也可以通过肠道微生物群 直接或间接 转化为几种 吲哚相关化合物 ,包括吲哚-3-丙酮酸、 吲哚-3-乳酸 、吲哚-3-丙酸、吲哚-3-乙酰胺、吲哚-3-丙烯酸、吲哚乙醛、吲哚-3-乙酸、 3-甲基吲哚(粪臭素) 等。
✦ 内源性吲哚产生的机制
大肠杆菌 ( E. coli )是研究最广泛的 吲哚合成生物体 ,它可以使用多种机制( 抑制 、 转录衰减 和 反馈抑制 )来调节色氨酸代谢中的 色氨酸操纵子 (Trp operon)和 tna操纵子 的表达。
在 色氨酸缺乏 的条件下, trp操纵子的 表达升高 ,而由TnaC(24个氨基酸前导肽,以前称为TnaL)、TnaA( 色氨酸酶 )和TnaB( 通透酶 )组成的tna操纵子的表达 受到抑制 ,因为转录终止因子(Rho)依赖性终止发生在 tna操纵子 中。
结果,当 色氨酸水平较低 时,TnaA和TnaB的表达以及吲哚的产生 受到抑制 。在 富含色氨酸 的条件下,转录终止因子依赖性转录终止被消除,因此 吲哚产量增加 。
因此,细胞外 色氨酸 和其他氨基酸 直接影响吲哚的产生 。
// 拓展:渗透酶通过转运也会影响吲哚水平
此外,三种 渗透酶 (Mtr、TnaB和AroP)在不同环境的 色氨酸转运 中发挥不同的作用,因此可以 直接影响吲哚的水平 。
Mtr通透酶 主要负责 转运吲哚 ,而 TnaB通透酶 对于 色氨酸的摄取 至关重要。尽管色氨酸的生产成本高昂,但细胞仍然利用色氨酸途径大量生产和 分泌吲哚 。
由色氨酸产生的吲哚可以通过 细胞膜蛋白 进行转运。例如, 大肠杆菌 和 霍乱弧菌 在丰富的培养基中可以分泌高达0.6 mM的吲哚。
在大肠杆菌中,外排蛋白AcrEF部分负责 吲哚的输出 ,因为AcrEF突变体的吲哚排泄低于其野生型菌株。Mtr通透酶主要负责 输入吲哚 ,因为吲哚不被mtr突变体吸收。
然而,最近有人提出,吲哚由于其 疏水性 ,可能可以直接扩散通过细胞膜。因此,有必要清楚地了解吲哚的进出口情况。
大肠杆菌中吲哚生物合成和吲哚信号传导
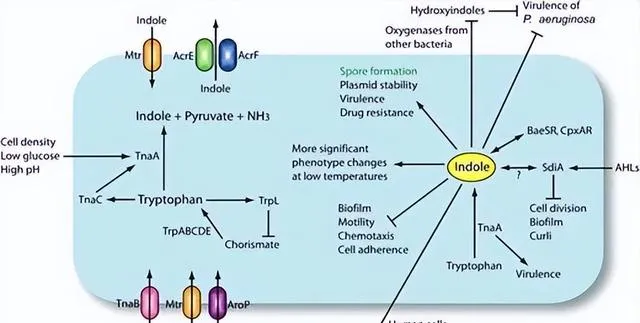
Lee JH, Lee J.FEMS Microbiol Rev.2010
人体粪便中吲哚的浓度较高,通常范围为 0.25毫摩尔浓度~1.1毫摩尔浓度 ,但可能由于人群之间 肠道微生物群组成的差异 以及 膳食蛋白质消耗水平不同 而存在差异区别。
注:由于 吲哚 似乎是通过 结肠上皮 吸收的,结肠中吲哚的浓度 可能高于 粪便中记录的浓度,远端大肠的浓度 高于 近端部分的浓度。
产生吲哚的细菌
尽管大多数生物体都含有色氨酸代谢途径,但只有 能编码tnaA的细菌 才能合成吲哚。 表达色氨酸酶 (tnaA)的细菌,例如 大肠杆菌 ( E. coli )、梭菌属( Clostridium spp.)、 拟杆菌属 ( Bacteroides spp.)和普通变形杆菌( Proteus Vulgaris ),可催化 色氨酸直接转化为吲哚 。
✦ 梭状芽孢杆菌代谢产生吲哚-3-丙酸
已经证明 吲哚-3-丙酸 是由 梭状芽孢杆菌 ( Clostridium sporogenes )产生的。 粪臭素 (3-甲基吲哚)是由 梭菌属 和 拟杆菌属 产生的。
此外, 产孢梭菌 ( C. sporogene )可以将 色氨酸 转化为 吲哚-3-丙酮酸 (IPyA),并在吲哚-3-丙酮酸脱羧酶的催化下产生吲哚-3-乙醛(IAAld)。然后,IAAld 被 厚壁菌门 、 变形菌门 、拟杆菌门和放线菌门的成员脱羧,产生 吲哚乙酸 (IAA)。
✦ 一些病原菌也可以产生吲哚
色氨酸代谢很复杂,许多菌株参与吲哚衍生物的制造。总的来说,数据支持迄今为止有 至少85种细菌 已被证明可以 产生吲哚 。
这些细菌包括许多 病原菌 ,例如 创伤弧菌 、 流感嗜血杆菌 、多杀巴氏杆菌( pasteurella multocida )、四种志贺氏菌菌株、 植物克雷伯菌 (Klebsiella planticola )和普通变形杆菌。值得注意的是,一些革兰氏阳性菌株,包括 B.alvei 和 粪肠球菌 ( E.faecalis )也 产生吲哚 。
✦ 一些拥有tnaA基因的细菌却无法产生吲哚
有趣的是,一些细菌,如 杀鲑气单胞菌 ( Aeromonas salmonicida )、宋氏志贺氏菌( Shigella sonnei )、 克氏耶尔森氏菌 ( Yersinia kristensenii )和 Seudovibrio spp.,已经 失去了合成吲哚 的能力,尽管这些菌株的染色体上有一个 tnaA基因同源物 。
例如,与正常志贺氏菌菌株不同,一些在 tna操纵子中具有点突变 、 插入 或 缺失 的志贺氏菌 不产生吲哚 ,这可能是由于某些适应性优势。虽然只是推测,但一些个体可能通过利用当地细菌群体的信号来 避免产生吲哚的成本 。
其他可以产生吲哚的细菌:
Alkaliphilus metalliredigens
Bacillus alvei
Clostridium novyi
Clostridium limosum
Clostridium tetani
Corynebacterium acnes
Desulfitobacterium hafniense
Nocardioidessp.
Oribacterium sinus
Propionibacterium acnes
Enterococcus faecalis
Symbiobacterium thermophilum
Aeromonas hydrophila
Aeromonas liquefaciens
Aeromonas punctata
Bacteroides thetaiotaomicron
Bacteroides sp.
Brachyspira hyodysenteriae
Burkholderiasp.
Chromobacterium violaceum
Chryseobacterium gleum
Citrobactersp.
Citrobacter intermedius
Citrobacter koseri
Desulfovibrio vulgaris
Edwardsiella tarda
Enterobacter liquefaciens
Escherichia coli
Escherichia fergusonii
Flavobacteria bacterium
Flavobacteriumsp.
Fusobacterium nucleatum
Fusobacterium polymorphum
Haemophilus influenzae
Haemophilus somnus
Haloarcula marismortui
Halogeometricum borinquense
Hyphomonas neptunium
Klebsiella ornithinolytica
Klebsiella planticola
Micrococcus aerogenes
Morganella morganii
Paracolobactrum coliforme
Pasturella multocida
Pasturella pneumotropica
Photobacterium harveyi
Porphyromonas asaccharolytica
Porphyromonas endodontalis
Porphyromonas gingivalis
Prevotella intermedia
Proteus inconstans
Proteus vulgaris
Providencia alcalifaciens
Providencia rettgeri
Providencia rustigianii
Providencia stuartii
Rhizobium leguminosarumbv.trifolii
Saccharomonospora viridis
Shigella boydii
Shigella dysenteriae
Shigella flexneri
Sphaerophorus varius
Stigmatella aurantiaca
Treponema denticola
Vibrio alginolyticus
Vibrio cholerae
Vibrio fluvialis
Vibrio harveyi
Vibrio hollisae
Vibrio mediterranei
Vibrio nigripulchritudo
Vibrio orientalis
Vibrio parahaemolyticus
Vibrio splendidus
Vibrio tapetis
Vibrio tubiashii
Yersinia frederiksenii
Yersinia intermedia
影响吲哚类物质生成的因素
吲哚类物质的生成可能受到环境因素的严重影响,例如 膳食成分 、肠道微生物群、碳源、 温度 、pH值以及 生理状态 。
★ 肠道微生物群和饮食对吲哚生成有重要影响
吲哚类物质是 肠道微生物群 产生的 膳食色氨酸 的代谢产物。因此, 肠道微生物组成 以及 饮食模式 的变化会影响其产生。
研究发现 吲哚-3-丙酸 (IPA)与肠道微生物群的 α多样性 呈 正相关 ,肠道微生物组的组成可以解释大约 20% 的IPA循环水平的变化。
高纤维和富含多酚的饮食可以提高吲哚含量
多项研究发现,吲哚-3-丙酸的循环水平与 纤维摄入量 相关,这可能是通过 肠道微生物群的变化 来解释的。
此外, 富含多酚 的饮食会导致肾功能正常受试者的 血清IPA显著增加 ,但肾功能受损的受试者不会显著增加。与此相一致的是,饲喂 菊粉 60天的猪的盲肠和结肠中 微生物组组成的β多样性显著增加 ,同时IPA含量也 显著增加 。
地中海饮食会导致吲哚-3-丙酸水平升高
不同的 饮食结构 也会改变吲哚的水平。例如, 地中海饮食 仅治疗4天后就导致 吲哚-3-丙酸水平升高 ,而 快餐 (即薯条和汉堡)则引起相反的结果。
此外,正常饮食喂养的同窝小鼠的血浆IPA水平 显著高于生酮饮食 喂养的小鼠。一项针对117名超重成年人的研究发现,摄入炸肉会 降低肠道微生物群落 的丰富度,并导致 IPA浓度下降 。
发酵食品可能会降低吲哚含量
通过对14名健康男性进行随机交叉研究设计,探讨了 发酵乳制品 对人类血清代谢组的影响。与牛奶组相比,酸奶摄入组餐后血中 吲哚-3-丙酸 和 吲哚乙酸浓度较低 。
同样,C反应蛋白水平轻度升高的健康超重男性在接受 抗炎膳食混合物 后,饮用500mL餐后奶昔(由300mL蛋奶冻、150mL奶油干酪和50mL鲜奶油组成)。受试者在后期表现出 吲哚-3-丙酸血浆浓度降低 。
总之,我们推测不同的 饮食结构 会 改变肠道微生物的组成 ,从而导致 吲哚类物质 产生的个体差异。
• 细胞群体密度影响吲哚分泌
细胞外吲哚浓度取决于 细胞群体密度 ,其中 大肠杆菌 和 霍乱弧菌 在指数 早期 开始产生吲哚。浓度在固定相中达到最高水平(在富集培养基中高达0.6mM吲哚),并在固定相期间 稳定维持 。
• 碳源影响吲哚产量
其次,有报道称 葡萄糖抑制吲哚 生物合成。TnaA的分解代谢抑制得到证实,因为tnaA基因的转录在 碳限制期间受到抑制 。
此外,tnaAB操纵子被大肠杆菌中的 分解代谢调节蛋白 环AMP复合物激活。因此,当 大肠杆菌数量较多且碳源减少 时,会产生 相对大量的吲哚 。
• 温度和pH影响吲哚生物合成
温度 和 pH 也是影响大肠杆菌吲哚生物合成的重要环境因素。温度从30°C转变到43°C会 诱导 大肠杆菌中 tnaAB基因 的表达,但大肠杆菌在44.5°C时 失去吲哚生物合成 的能力。
注:与37°C相比, 吲哚信号传导 在较低温度(30°C)下对大肠杆菌基因表达、生物膜形成和抗生素耐药性的控制作用 更为显著 。
此外, 低pH值会抑制 大肠杆菌中吲哚的产生,而TnaA是 pH9.0 时最容易诱导的蛋白质之一。
• 生理状态影响吲哚生成
例如 年龄 、 性别 以及 个体的生理状态 都可能影响内源性吲哚的产生。 睡眠模式 、 压力水平 和 运动习惯 等生活方式因素都可能对内源性吲哚的产生产生影响。
此外,特定的健康状况和疾病,如 肠道炎症 、 肝脏疾病 等,可能会改变内源性吲哚的 生成或代谢 。
• 药物的使用也会影响吲哚生成
一些药物可能影响吲哚类物质的生成。例如,一些 抗生素 和 非甾体抗炎药物 被发现可以 改变肠道微生物群 的组成和功能,从而影响 吲哚类物质的生成 。
此外,一些药物可能直接 干扰色氨酸代谢途径 ,从而影响吲哚类物质的生成。
小结
因此,细胞群密度、碳源、 温度 和 pH 等环境条件直接会影响吲哚的浓度;而 饮食 、 药物的使用 以及生活方式可能通过 影响肠道微生物群 或其他器官 间接影响吲哚的生成 。
吲哚类物质对肠道功能的影响
肠道屏障 的功能与 肠道健康 密切相关,在健康中发挥着至关重要的作用。肠道屏障将宿主与肠腔中的微生物隔离,并 限制 微生物和分子从肠腔的运动。
一旦肠道屏障受损, 肠道通透性增加 ,细菌及其产物(如内毒素)将跨膜并 激活 单核巨噬细胞系统,促进 大量炎症因子的产生 ,如白细胞介素6和肿瘤坏死因子-α(TNF-α),导致 慢性微炎症状态 。
吲哚 对于 控制肠道屏障功效 至关重要,包括 调节炎症和免疫反应 、影响上皮通透性、 粘液产生 和紧密连接(TJ)形成。
影响肠道免疫
✦ 吲哚减轻非甾体抗炎药引起的肠道炎症
研究了使用 吲哚 作为 非甾体抗炎药肠病 的治疗方法。吲哚 降低 粪便钙卫蛋白浓度以及吲哚美辛诱导的脾和肠系膜淋巴结中 中性粒细胞的浸润 。
吲哚与吲哚美辛 联合使用 可 减少 非甾体抗炎诱导的粘膜转录组变化。粪便钙卫蛋白是肠道炎症的中性粒细胞 特异性生物标志物 。而中性粒细胞被认为是非甾体抗炎肠病发病的关键因素,可通过释放多种炎症介质引起 炎症和组织损伤 。
这就说明 吲哚 能够 减轻 吲哚美辛引起的小鼠肠道炎症,对非甾体抗炎药肠病具有 潜在的免疫调节作用 。
此外还发现 吲哚减少促炎细胞因子 IL-8的产生和趋化因子TNF-α激活的 核因子κB (NF-κB)的表达,并 诱导抗炎细胞因子 IL-10的分泌。
研究表明,共生菌可以 限制 鼠伤寒沙门氏菌诱导的NF-κB激活, 减轻小鼠炎症 。因此,吲哚 可能是益生菌减少肠道炎症的信号 。
✦ 细菌产生的吲哚衍生物增强免疫屏障
吲哚乙酸
卵形拟杆菌 ( Bacteroides ovatus )产生的 吲哚乙酸 (IAA) 增加 了CD103+ /CD11c+免疫群体的丰度,而 CD103+ /CD11c+免疫细胞对于 维持肠道免疫稳态 和 诱导耐受性免疫反应 至关重要。
此外, 吲哚乙酸 与树突状细胞上的芳基氢受体结合并驱动 IL-22的产生 。在 炎症性肠病 个体中,IL-22 刺激上皮再生并 减少炎症 ,并且在 肠道炎症的调节 中发挥关键作用。
注:除卵形拟杆菌外,其他拟杆菌产生的吲哚也可以 激活免疫细胞上的AhR ,从而 产生IL-22 。
在脂多糖存在的情况下,肠上皮细胞中表达的Reg4通过 增加乳酸菌 及其代谢物 吲哚乙酸 的比例来 维持免疫稳态 ,从而 促进 肠组织中IL-35 +B调节细胞的产生和积累。这些结果表明 吲哚乙酸 可以调节IL-35 的产生,并 影响肠道免疫屏障 。
吲哚-3-乳酸
罗伊氏乳杆菌 ( Lactobacillus reuteri )产生吲哚-3-乳酸(ILA),ILA是Trp的吲哚衍生物,可 激活 CD4+ T细胞中的AhR并 下调 转录因子ThpoK,使CD4 + T细胞分化为具有 免疫调节功能 的CD4+ CD8αα +双阳性上皮内T淋巴细胞(DPIELs)。通过这些机制,吲哚-3-乳酸可以 促进 肠道屏障功能并减少炎症。
生活在母乳喂养婴儿胃肠道中的 婴儿长双歧杆菌亚种 也可产生吲哚-3-乳酸,从而 显著减弱 TNF-α和脂多糖诱导的肠上皮细胞中促炎细胞因子IL-8的增加。吲哚-3-乳酸还 增加 AhR靶基因CYP1A1和NRF2靶向基因谷胱甘肽还原酶2、超氧化物歧化酶2和NAD(P) H脱氢酶的 mRNA 表达,这可能是母乳喂养婴儿肠道炎症的 重要调节剂 。
此外,另一项研究表明, 婴儿双歧杆菌 分泌的吲哚-3-乳酸对未成熟肠道具有 抗炎作用 。这些数据为生产 吲哚-3-乳酸益生菌 的生产和饮食建议提供了重要的见解。
吲哚-3-丙酸
吲哚-3-丙酸(IPA) 下调 肠上皮细胞介导的炎症细胞因子TNF-α,同时上调配体蛋白编码mRNA,从而 调节肠道屏障功能 , 缓解肠道炎症 。
吲哚-3-丙酸还通过 激活 AhR 显著诱导 肠上皮细胞上的IL-10受体配体结合亚基(IL-10R1)来 调节肠道免疫稳态 。
IL-10R1是 抗炎细胞因子 IL-10的受体,IL-10通过IL-10R1发送 抗炎信号 , 抑制 多种细胞(包括肠上皮细胞)过度释放促炎介质。这进一步说明了吲哚-3-丙酸对 肠道免疫屏障 的保护作用。
吲哚-3-醛
乳杆菌( Lactobacillus )产生的吲哚-3-醛(IAld)有助于AhR依赖性IL22转录,IL-22产生者 抑制炎症 并 保护粘膜表面 的免疫生理学。吲哚-3-醛可以替代益生菌,在感染或化学损伤期间保护和 维持粘膜完整性 。
吲哚-3-醛可用作菌群处理和肠道菌群失调期间的支持疗法。乳酸菌还通过IAld诱导的AhR 刺激 LPL分泌IL-22,从而 激活 pSTAT3通路并 抑制 IL-1β和TNF-α分泌,以 保护粘膜免疫屏障.
吲哚对肠道免疫的影响

Ye X,et al.Front Immunol.2022
增加有益菌株,抑制病原菌
服用 非甾体抗炎药 时,肠道微生物组以革兰氏阴性菌为主,这种转变会导致 肠道损伤 。吲哚和吲哚美辛的共同给药可以 维持甚至增加 厚壁菌门的重要成员,特别是对 肠道稳态 至关重要的 C. cluster XIVa 和 C. cluster IV 。似乎它可以 防止 拟杆菌的任何增加,这种变化可以 减少肠粘膜损伤 。
吲哚可通过 增殖 MUC基因的表达来 增加 HCT-8细胞对去甲肾上腺素介导的 肠出血性大肠杆菌 (EHEC) 沉降的抵抗力 。
吲哚-3-醛 (IAld) 激活 AhR以产生IL-22,IL-22 调节粘膜反应 ,使混合微生物群落存活并抑制白色念珠菌( Candida albicans )定植
调控肠道病原体毒力基因的表达
✦ 减轻克雷伯菌属的细胞毒性
吲哚 调节多种肠道细菌的 毒力因子 。吲哚 增强 替利霉素向替利伐林的转化。两者均由 克雷伯菌属 ( Klebsiella spp. )产生,不同之处在于替利伐林是一种 细胞毒性降低 的吲哚类似物,并且替利伐林与上调孕酮X受体(PXR)反应性解毒基因结合并 抑制 微管蛋白定向毒性。因此,吲哚以多种方式 减轻克雷伯菌属的细胞毒性 。
✦ 调节霍乱弧菌和大肠杆菌的毒力基因表达
肠道益生菌代谢产生的吲哚在肠腔内浓度较高, 减少 了肠道大肠杆菌和 啮齿类柠檬酸杆菌 ( Citrobacter rodentium )致病基因的表达。
吲哚还用作ToxR激动剂, 调节 肠道内 霍乱弧菌 ( Vibrio cholerae )的毒力基因表达和 生物膜产生 。吲哚、吲哚甲酸和吲哚乙酸还可 下调致病性大肠杆菌菌株 的 毒力 和志贺氏毒素的产生。
此外,吲哚和7-羟基吲哚 显著改变 铜绿假单胞菌( Pseudomonas aeruginosa )的 毒力基因表达 ,从而 降低毒力因子 并降低 集群运动性 。
铜绿假单胞菌用7-羟基吲哚治疗后,胃肠道中有 更好的清除率 。因此,吲哚可能有助于作为针对 肠出血性大肠杆菌等病原体的治疗剂。
增强肠道屏障功能
✦ 增强肠道机械屏障
吲哚通过诱导许多涉及内皮细胞的基因的表达,包括 紧密连接 、粘附分子连接(AJ)、肌动蛋白细胞骨架和 黏蛋白 形成,在体外 增强内皮细胞的屏障功能 。
将人肠上皮细胞系HCT-8暴露于 吲哚 以测量其基因表达的变化。结果显示,高剂量的吲哚 增强 了肠上皮细胞HCT-8中与 黏蛋白产生 、 粘膜屏障增强 和上皮间抵抗相关的分子谱。因此, 吲哚加强了机械屏障 。
✦ 增强肠道粘液屏障
吲哚-3-丙酸通过 增加 MUC2和MUC4以及 杯状细胞分泌产物 (TFF3和RELMβ)来 增强粘液屏障功能 。
吲哚-3-丙酸还 促进IL-10释放 ,IL-10的信号转导 增强粘液屏障功能 并维持上皮细胞的稳态。
细菌中的吲哚-3-丙烯酸(IA)可 增强 IL-10的产生和MUC基因的表达,而 IL-10 对于维持杯状细胞中MUC的产生至关重要。因此,吲哚-3-丙烯酸通过 IL-10 间接影响粘液屏障 。
吲哚通过AhR或PXR调节肠道屏障
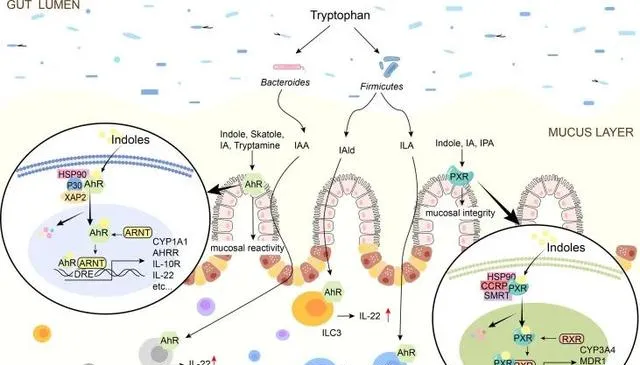
Ye X,et al.Front Immunol.2022
吲哚在微生物群落中的作用
研究发现 吲哚 在细菌中发挥多种生物学作用,包括 孢子形成 、 耐药性 、毒力因子、质粒稳定性和 生物膜形成 等。
吲哚可以作为细菌间的信号分子
事实上,吲哚可以作为一种 细菌信号 ,参与同一物种内以及不同物种之间的通讯。它在细菌生态系统中充当 细胞间和细胞内信号 。
注:吲哚还诱导了 S. aurantiaca 的孢子形成。
通过遗传筛选,在 大肠杆菌 中研究了吲哚作为细胞外信号分子的可能。结果,四个基因(astD、cysK、gabT和tnaB)被证明在稳定期通过自身产生的细胞外信号的积累而 被激活 。
在后续研究中,吲哚被证实是astD、gabT和tnaB激活 所需的细胞外信号分子 。
吲哚作为细胞间信号分子存在哪些争议?
吲哚是否是细胞间信号分子一直存在争议。已经提出了对群体感应信号分子要求的许多标准,如下所示:
1.假定的信号必须在 特定阶段 产生,吲哚主要在 固定相 中产生。
2.假定的信号必须在细胞外积累并被特定受体识别。吲哚的化学性质是众所周知的,并且在大多数吲哚调节情况下,化学互补被证明,其中吲哚在稳定期积累并且是已知的 细胞外信号 。该受体由AcrEF输出并由Mtr输入。
3.假定的信号必须 累积并产生一致的响应 ,吲哚已被证明可以 控制孢子 和 生物膜的形成 。
4.重要的是,假定的信号必须引起 超出信号代谢 或解毒所需的生理变化的反应。吲哚已被证明可以 控制毒力 、生物膜和 质粒稳定性 ,这些与吲哚无关代谢。
因此,根据这些标准,吲哚有可能成为 群体感应分子 。
由于上述四个标准仅适合规范的群体感应信号,例如AHL,Monds&O'Toole又添加了两个更普遍适用且具有实用价值的标准:
1.表型变化所需的 生理相关信号浓度对细胞无毒 。大肠杆菌和霍乱弧菌产生高达0.6mM的吲哚,对细胞无毒,并在该生理浓度下控制许多表型。
2.信号网络在社区层面是自适应的。尽管由于进化实验的困难而难以证明,但我们假设细胞间信号吲哚可能对 微生物群落有益 ,尽管吲哚的生产对个体来说成本高昂。
例如,吲哚在产生吲哚的细菌大肠杆菌和霍乱弧菌中 增加了质粒稳定性 、 耐药性 。相反,在不产生吲哚的细菌中,吲哚通过干扰群体感应系统, 降低 了真菌的细胞生长和 铜绿假单胞菌的毒力 。因此,我们推测 产生吲哚的细菌可能利用吲哚来对抗其他细菌和真核生物 。
吲哚影响病原菌的毒力
吲哚 和 tnaA基因 也 影响病原菌的毒力 。色氨酸酶活性与 致病性大肠杆菌 有关,因为色氨酸酶活性是LEE1启动子 完全激活所必需的 。
吲哚会 增加 肠出血性大肠杆菌中 毒力相关 的EspA和EspB蛋白(LEE4基因产物)的分泌以及附着和消除病变的形成。
在 霍乱弧菌 中,吲哚和tnaA基因可能通过 诱导毒力 相关的分泌蛋白来 增加 对盘基网柄菌( Dictyostelium discoideum )的抗性。
此外,在流感嗜血杆菌分离株中,大多数血清型 (94-100%)呈 吲哚阳性 ,而 无害分离株 中只有70-75%呈吲哚阳性。结果表明,吲哚的产生是必要的,但不足以对该菌株产生毒力。
值得注意的是, 吲哚 通过 抑制毒素 的产生来 减轻 克雷伯菌属( Klebsiella spp)的 细胞毒性 ,还通过 降低 细胞运动性和聚集性来减少李斯特菌( L. monocytogenes )的 相关毒力 。
吲哚 还通过 改变基因表达 来 减少 铜绿假单胞菌(不产生吲哚的细菌)中 毒力因子 的产生。
吲哚降低毒力基因的表达
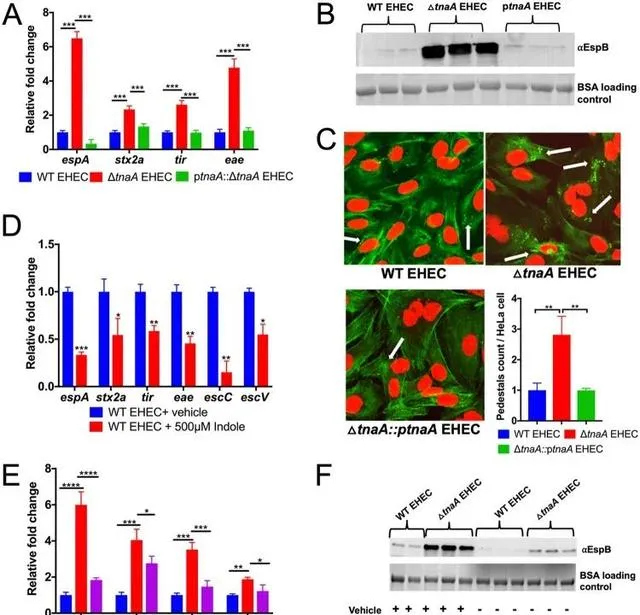
Kumar A,et al.mBio.2019
吲哚增加了大肠杆菌的耐药性
研究表明, 吲哚 通过在大肠杆菌中 诱导 输出基因(mdtEF和acrD)来 增加耐药性 ,其中吲哚通过双组分信号转导系统(BaeSR和CpxAR)发挥作用。
这些双组分信号系统可以用作 吲哚传感器 。该结果证实了另一项研究,其中吲哚通过BaeSR和CpxAR 诱导 spy(球形体蛋白Y)基因的表达。
此外,有人认为GadX(AraC型转录因子)、Hfq(sRNA功能的全局调节因子)和RpoS(应激和固定相西格玛S)对 吲哚诱导 的mdtEF表达是必需的。因此, 吲哚 可能与多种 调节因子 相互作用。
吲哚对细菌的其他作用
增强大肠杆菌的质粒稳定性
吲哚 增强 大肠杆菌中的 质粒稳定性 。研究表明,来自大肠杆菌质粒ColE1的小非编码RNA与TnaA结合,有助于 防止质粒丢失 ,而吲哚则 延迟细胞分裂 。
大肠杆菌中的吲哚还通过 抑制 gadABCEX、hdeABD和ymgB等耐酸基因来 降低耐酸性 。大肠杆菌可能会在 弱碱性肠道菌群 中存在吲哚的情况下关闭耐酸性基因,因为在通过酸性胃存活后不再需要耐酸性蛋白。
降低了运动性
此外,吲哚是一种化学排斥剂,会 降低运动性 ,可能是由于细胞分裂干扰,而肾上腺素和去甲肾上腺素是一种化学引诱剂,会 增加 大肠杆菌O157: H7的运动性。
此外,吲哚 降低 细胞 对上皮细胞的粘附 ,而肾上腺素和去甲肾上腺素 增加细胞粘附 。由于细菌粘附和定植到上皮细胞对于感染很重要,因此假设这也会对 细菌毒力 产生不同的影响。
吲哚对其他微生物的影响如下所示:
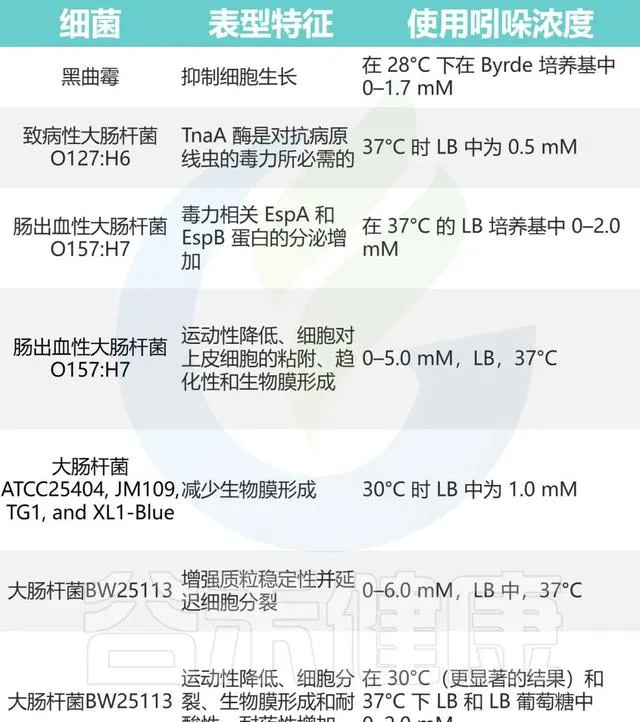

Lee JH, Lee J.FEMS Microbiol Rev.2010
吲哚改善疾病
吲哚类物质被 肠上皮细胞 吸收并扩散到血液中,从而循环到全身并影响各个系统,例如 肠道 及相关疾病的调节。
谷禾在这里总结了它们对 炎症性肠病 、 出血性结肠炎 、结直肠癌、糖尿病、 中枢神经系统炎症 和血管调节的影响。
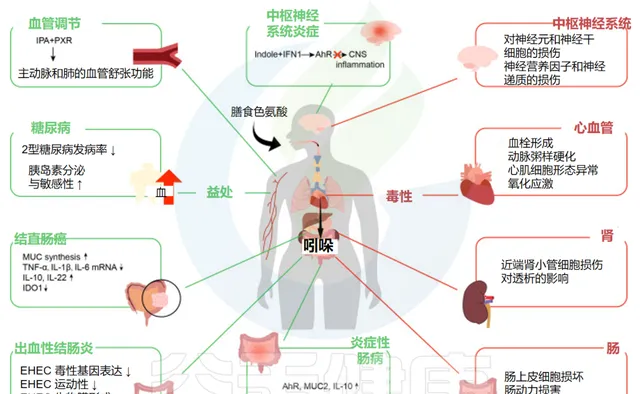
Ye X,et al.Front Immunol.2022
缓解炎症性肠病
炎症性肠病是克罗恩病、溃疡性结肠炎等一组疾病的总称,是临床上重要的 慢性胃肠道炎症性疾病 。大量研究表明, 吲哚 对 缓解炎症性肠病症状 有一定的作用。
✦ 吲哚类物质增加了抗炎细胞因子
炎症性肠病与 粘液层 有关,炎症性肠病患者的内部粘液层 较薄 ,MUC2糖基化 较低 。结果表明, 吲哚-3-丙烯酸甲酯 (IA)处理小鼠结肠球体可 显著增加 AhR激活和MUC2基因表达。
即使在脂多糖刺激的共培养物存在下,IA仍能保持其对MUC2基因表达的影响并 增加IL-10 的产生。杯状细胞产生MUC依赖于IL-10。因此,细菌产生的 IA 有可能 增加 IL-10的产生和MUC基因的表达,这可能 对炎症性肠病患者有利 。
改善出血性结肠炎
吲哚 对于 肠出血性大肠杆菌 的发病机制至关重要。出血性结肠炎是一种出血性腹泻,可导致 溶血性尿毒症综合征 ,由人类病原体大肠杆菌O157:H7引起。
✦ 吲哚减少了肠出血性大肠杆菌的定值
根据表面相关EHEC的DNA微阵列研究,吲哚 降低 了EHEC中与 表面定植 和 致病性 有关的基因表达。
吲哚可以被加氧酶氧化,产生新的 种间生物膜信号 ,从而以多种方式影响相同的表型(生物膜产生)。大肠杆菌K-12和肠道内其他共生菌产生的吲哚可能会 限制 大肠杆菌K-12生物膜的产生,并通过改变SdiA的表达来 降低非致病性大肠杆菌的运动性 ,从而 影响 EHEC趋化性和粘附力。粘附测定证实,吲哚可在体外 减少 EHEC与上皮细胞的附着。
总之,吲哚通过 改变肠出血性大肠杆菌毒性基因 的表达、 减少其运动性 和生物膜形成以及 减少粘附 来 减轻 肠出血性大肠杆菌感染并 改善出血性结肠炎 。
抑制结直肠癌的发展
根据越来越多的数据, 肠道吲哚 ,特别是 色氨酸代谢物 ,似乎在 结直肠癌 中发挥着重要作用。吲哚刺激AhR,它可以直接作用于肠道干细胞, 维持 MUC合成并 改善肠道屏障功能 。
然而,在炎症相关结直肠癌发生模型中,阻断吲哚-AhR信号通路会 显著增加 TNF-α、IL-1β和IL-6 mRNA水平。
此外,吲哚衍生物 色胺会抑制 吲哚胺2,3-双加氧酶(IDO1),该酶参与 肿瘤免疫耐受 。这些发现表明 肠道菌群产生的吲哚可能会减缓结直肠癌的进展 。
与健康个体相比,结直肠癌患者的 吲哚/色氨酸比率较低 ,犬尿氨酸(kyn)/色氨酸比率较高。在结直肠癌患者中,犬尿氨酸和IDO1的 表达增加 , 吲哚的产生减少 。
吲哚产生的下降 削弱了对结肠癌的抑制作用 。总体而言,有证据表明微生物色氨酸-吲哚代谢途径的改变在 结直肠癌的发病机制 中发挥着重要作用。
预防2型糖尿病
较高的 吲哚-3-丙酸 血清浓度可 降低患2型糖尿病 的可能性,并 增强胰岛素分泌和敏感性 。
研究发现,与喂食对照饮食的大鼠相比,喂食吲哚-3-丙酸饮食的大鼠的空腹血糖水平 显著降低 。根据其他研究,吲哚可以 调节 小鼠结肠成纤维细胞 释放胰高血糖素样肽-1 (GLP-1)。
✦ 吲哚调节胰高血糖素样肽-1的释放
吲哚在短时间内 增加 GLP-1的释放,在较长时间内减少其分泌。这些作用结果的产生是因为吲哚可以影响 L细胞 的两个关键化学途径。
在某种程度上,吲哚可以 抑制 电压门控K+通道, 增加 L细胞诱导的动作电位持续时间,并 导致 Ca2+进入 大量增加 ,从而快速 促进GLP-1的分泌 。吲哚抑制了NADH脱氢酶,随着时间的推移减缓ATP的生成并 降低GLP-1的释放 。
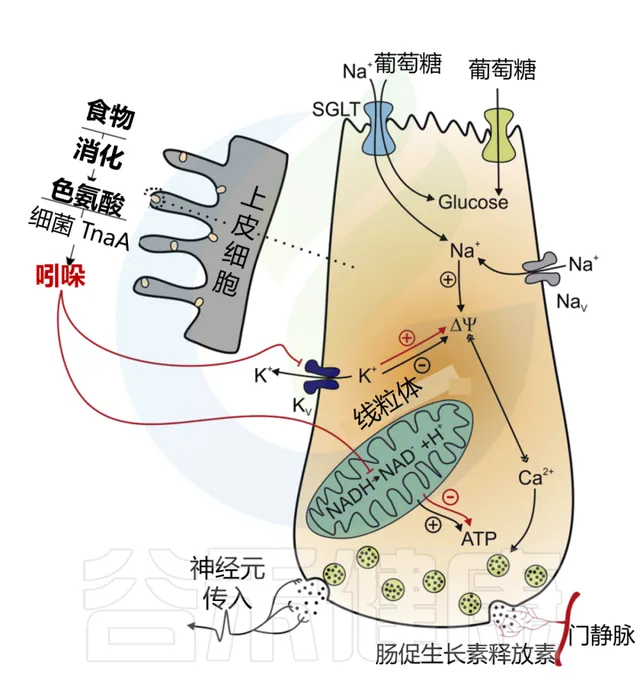
Chimerel C,et al.Cell Rep.2014
肠道内的吲哚可能还会 影响食欲 ,同时,吲哚-3-丙酸具有强大的 抵抗氧化应激 的能力,这表明这种代谢物可以 保护β细胞 免受代谢和氧化应激相关的损伤以及淀粉样蛋白积累。因此, 肠道微生物群代谢产生的吲哚-3-丙酸对2型糖尿病具有保护作用 。
保护肺部免受细菌和真菌感染
体外实验发现, 吲哚丙酸 也是嗜肺军团菌( Legionella pneumophila )生长的 强效抑制剂 ,且 抑菌效果 随着 吲哚丙酸浓度 和暴露时间的增加而 增强 。因此,吲哚丙酸可以 抑制细菌引起的肺部炎症 。
HIV阳性患者通常更容易感染 结核病 ,这是 死亡率增加 的重要因素,两种疾病的共同感染可能会因 抗逆转录病毒药物 和 抗结核药物 之间的相互作用而使治疗复杂化。
值得注意的是, 吲哚丙酸 可能是此类治疗中潜在的药物成分。有研究发现,接受抗逆转录病毒治疗的HIV患者体内吲哚丙酸含量 显著下降 ,这是区分HIV感染者与健康人的 重要标志物 。
这种作用的机制尚不清楚,但部分原因是 肠道屏障受损 导致脂多糖和脂多糖结合蛋白易位,从而 加剧全身炎症反应 。此外,接受抗逆转录病毒治疗的HIV患者也 容易出现 非酒精性脂肪性肝病/非酒精性脂肪性肝炎,进一步说明了 吲哚丙酸 在各种疾病中的多种治疗潜力。
相比之下, 吲哚丙酸 是一种小分子代谢产物,具有良好的药代动力学特性,很容易被宿主吸收,充分发挥治疗作用。
未来,吲哚丙酸有望通过其作为 抗结核病 和 抗逆转录病毒药物 的补充的潜力来改善某些疾病的现有治疗选择。
改善血管舒张作用
吲哚丙酸可以 触发孕烷X受体 (PXR),一种生物量激活的核受体,存在于包括血管内皮在内的各种组织中,以 调节内皮功能 。
吲哚丙酸通过PXR 调节主动脉 和 肺动脉导管 中激动剂诱导的 内皮依赖性松弛 。这种调节主要是由于内皮一氧化氮合酶产生的一氧化氮的改变,而内皮一氧化氮合酶受到吲哚丙酸介导的PXR激活的抑制。
然而,破坏肠道微生物群并 降低 吲哚丙酸丰度的 抗生素治疗 会通过改变内皮PXR途径来 改变吲哚丙酸的血管舒张作用 。
而微生物代谢的吲哚丙酸补充可以 提高全身吲哚丙酸水平 并 刺激 PXR表达,从而 逆转 抗生素治疗引起的主动脉和肺动脉中激动剂诱导的内皮依赖性血管舒张的增强。
注:吲哚与血管的相互作用可能会 显著改变 传统传染病或结肠手术相关的抗生素治疗,导致微生物群落紊乱。
吲哚的潜在副作用
尽管吲哚对于 改善肠道 甚至 全身疾病 至关重要,但它们中的一些仍然会产生 负面影响 ,例如 硫酸吲哚酚 (IS)、吲哚基-β-d-葡萄糖苷和 吲哚乙酸 。
硫酸吲哚酚是最重要的 肾毒性代谢产物 之一,其肾毒性已在临床研究中得到广泛证实。此外,一些吲哚类物质还会对 胃肠系统 、 神经系统 和 心血管系统 产生毒性。
过量的吲哚会对情绪和行为产生不利影响
越来越多的证据表明吲哚和吲哚化合物对 大脑代谢 、生理和 宿主行为 有影响。在拥有产生吲哚的大肠杆菌的大鼠中, 吲哚的慢性过量产生 已被证明会 增强焦虑样行为和抑郁 。
另一项研究还发现,给予常规大鼠 肠道内吲哚 可以 激活 一个称为迷走神经背侧复合体的大脑核。通过比较与非吲哚产生大肠杆菌菌株或吲哚产生大肠菌菌株单体相关的小鼠,发现肠道微生物群的 长期高吲哚产生增加 了慢性压力对 整体情绪行为 不利影响的 敏感性 。
✦ 可能影响儿童自闭症的发病率
在人类中,一项研究发现,患有 自闭症谱系障碍 的儿童在大便样本中 吲哚水平较健康儿童低 ,而 3-甲基吲哚水平升高 。 这两种吲哚与患者中更常见的 梭菌属细菌 有关。
肠道微生物代谢活性产生的血浆吲哚升高与 肝性脑病 有关,这是由肝功能障碍引起的 神经精神障碍 ,以及个体意识、行为和个性的变化。
此外,NutriNet-Santé观察性前瞻性研究的结果表明,尿液中 吲哚和吲哚化合物浓度 与反复发作的 抑郁症状呈正相关 。这种相关性提出了这样一个假设: 肠道微生物过度产生这些化合物可能在人类情绪障碍的出现中起到作用 。
硫酸吲哚酚会导致肠道损伤、影响肠道蠕动
硫酸吲哚酚由 肠道菌群 和 宿主 共同代谢。肠道菌群用酶分解食物中的 色氨酸生成吲哚 ,然后由门静脉携带至 肝脏 ,在细胞色素P450酶和磺基转移酶的作用下转化为硫酸吲哚酚。
硫酸吲哚酚通过 上调 IRF1表达、 抑制 动力相关蛋白1表达并干扰线粒体自噬通量来 诱导肠上皮细胞(IEC)损伤 。硫酸吲哚酚通过以 浓度依赖 的方式增加活性氧的释放,在IEC-6细胞中引起 氧化应激 。
硫酸吲哚酚还 抑制 NRF2激活, 降低 抗氧化防御细胞系统并 抑制 血红素加氧酶-1、NAD(P)H 脱氢酶和 超氧化物歧化酶 的表达。
在IEC-6细胞中,硫酸吲哚酚处理可 显著增加 TNF-α的释放、 环氧合酶-2 和诱导型一氧化氮合酶的产生以及硝基酪氨酸的合成,表明 肠上皮细胞 是硫酸吲哚酚 诱导的肠道炎症 的靶点。
与硫酸吲哚酚一起培养的结肠显示出 收缩性降低 ,这表明该毒素可能对结肠平滑肌细胞产生 有害影响 并导致 肠道蠕动受损 。
影响中枢神经系统功能
微生物群代谢物硫酸吲哚酚在 中枢神经系统疾病 的发生中也具有 致病作用 。众所周知,慢性肾病和心血管疾病常常是由 硫酸吲哚酚 引起的。此外,肾功能不全会导致 尿毒症毒素 在大脑中积聚,导致 中枢神经系统功能异常 。
✦ 损伤神经元和神经干细胞
其次,硫酸吲哚酚可 损伤神经元 和 神经干细胞 ,损害神经营养因子和神经递质, 诱发 氧化应激和神经炎症。例如,通过作用于中枢神经系统胶质细胞,硫酸吲哚酚 促进神经炎症 并表现出 促炎作用 。
小鼠表现出 情绪障碍 和 神经元退化 的行为证据,如焦虑、 抑郁 和 认知功能障碍 。这些相应的器质性病变伴随着这些行为变化。这也表明 硫酸吲哚酚 和 中枢神经系统疾病 之间似乎存在病理联系。
吲哚对神经和神经精神疾病的影响
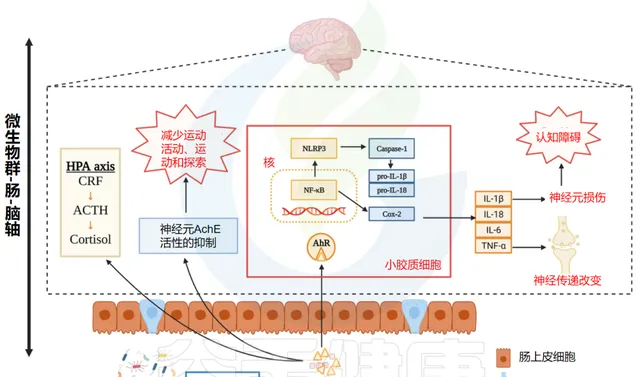
Zhou Y,et al.Neuropharmacology.2023
硫酸吲哚酚对大脑产生有益或有害的影响取决于含量:
通过比较患有 抑郁症 的志愿者和健康参与者,鉴定出了22种尿液代谢物,并且两组受试者之间的丰度 存在差异 。患有严重抑郁症的个体尿液中 硫酸吲哚酚浓度低于 健康人。在志愿者中,血清硫酸吲哚酚浓度与 精神焦虑 和相关的基于功能磁共振成像的 神经特征 有关。
在实验性自身免疫性脑脊髓炎的小鼠模型中,每日腹腔注射硫酸吲哚酚(10mg/kg)可 调节星形胶质细胞活性 ,并通过芳基烃受体对中枢神经系统发挥 抗炎作用 。相反,当大鼠口服 较高剂量 (100和200mg/kg)的硫酸吲哚酚时,观察到 空间记忆受损 以及 运动和探索活动减少 。
另一项研究发现,单次腹腔注射更大剂量(800mg/kg)的硫酸吲哚酚会引起与 神经元坏死 相一致的大脑组织学变化。硫酸吲哚酚在15-60微摩尔范围内使用时,会 诱导 原代星形胶质细胞产生自由基氧,并导致 海马神经元细胞死亡 。在10微摩尔浓度下,硫酸吲哚酚通过 氧化应激 诱导 人星形胶质细胞凋亡 。
肾功能不全时,硫酸吲哚酚是有害的
在 慢性肾病 (CKD)患者中,硫酸吲哚酚与 心血管健康 和全因死亡率相关。硫酸吲哚酚是血液透析患者发生心血管疾病的重要因素。在血液透析中,发现游离形式硫酸吲哚酚水平与成纤维细胞生长因子23呈 正相关 ,与C-C基序趋化因子15、补体成分C1q受体、串珠素(Perlecan)、博来霉素水解酶、分化簇166抗原和信号淋巴细胞活化分子家族成员5呈 负相关 。
这些蛋白质在 血管修复 和 内皮生长 中发挥着至关重要的作用。硫酸吲哚酚还可以通过 增加血小板过度活跃 、提高血浆促凝血水平和产生促凝血颗粒来导致 血栓形成 和 动脉粥样硬化 。硫酸吲哚酚通过增加 炎症 、心脏纤维化、心肌细胞增殖来 影响心脏组织 。
并且强有力的证据表明,硫酸吲哚酚在 肾功能不全 的情况下积累时是有害的。硫酸吲哚酚会 损害近端肾小管细胞 并 诱导炎症 和纤维化发展。肾脏通过肾小管分泌实现硫酸吲哚酚的高清除率,而硫酸吲哚酚与血浆蛋白结合超过90%,受到蛋白结合的限制,并且血液透析患者的血浆水平相对较高,这也表明与 肾脏疾病密切相关 。
羟吲哚可能降低神经元兴奋性
啮齿动物口服新霉素(一种广谱抗生素)会 降低脑内羟吲哚含量 ,因此表明羟吲哚至少部分源自 肠道微生物群代谢活动 。
有趣的是,最近在 人类粪便 样本中发现了羟吲哚,从而证实 肠道微生物 是这种代谢物的来源。在人类粪便中存在的细菌代谢物中,羟吲哚被发现是主要的 芳基烃受体激活剂之一 。
大鼠海马切片的体外实验表明,羟吲哚可能与电压门 控钠通道 相互作用,增加产生动作电位的阈值,从而大大 降低神经元的兴奋性 。
大胆推测
这些结果说明 羟吲哚 可能与已知的 神经抑制化合物 具有一些共同特征,从而能够 降低神经元的兴奋性
吲哚相关治疗
吲哚及其衍生物可以 影响肠道健康 甚至是全身其他器官的健康,而 过高或过低 的水平都可能带来不利影响,导致一些 疾病的发生 。
调节人体内吲哚水平 的机制主要有3种:首先,它可以通过 调节与吲哚产生相关的肠道微生物群的丰度 来影响吲哚的水平。
先前的研究发现,特定的肠道微生物群成员在 色氨酸转化为吲哚 的过程中发挥着不可或缺的作用,例如 产孢梭菌 ( Clostridium sporogenes ),它已被证明可以通过氧化和还原途径产生 吲哚乙酸 和 吲哚-3-丙酸 。在 大肠杆菌 中也发现了 吲哚活性转运蛋白 ,在 乳杆菌 中也发现了色氨酸酶的表达,并 有助于将色氨酸转化为吲哚 。
其次, 饮食调整 可以 增加或减少色氨酸的摄入量 ,从而 间接影响 体内的吲哚水平。
最后,直接作用于 AHR受体激动剂的药物 可能会发挥与吲哚类似的作用。
补充益生菌
益生菌 可以通过多种机制与体内微生物群相互作用,对 宿主健康产生有益影响 。
临床试验表明,益生菌可以 抵消 肠道微生物失衡造成的负面影响,并可 导致吲哚产生属及其衍生物的富集 ,如乳杆菌( Lactobacillus )。在另一项临床试验中,具有 抗炎作用 的 双歧杆菌 属在益生菌治疗后的丰度也 显著增加 。
益生菌还有可能成为神经和精神疾病的 治疗辅助药物 。在一项针对 抑郁症 和海马体功能变化的研究中,接受益生菌治疗的小鼠表现出肠道微生物 生态失调的显著缓解 ,以及 较低的肠道炎症介质 如IL-1β、TNF-α和iNOS的表达水平。此外, 情感行为 也被检测到与肠道微生物群组成变化相关的 显著改善 。
施用益生元、合生元
益生元是宿主细菌可以选择性利用并提供 健康益处 的底物。常见的益生元包括低分子量碳水化合物、 多酚 和 多不饱和脂肪酸 。
在实验室和临床试验中,益生元(包括 菊粉 和 低聚半乳糖 )已被证明可以 显著提高产生吲哚的益生菌 (例如双歧杆菌和乳酸杆菌)的丰度。在对肠道微生物失衡进行一定纠正后,吲哚作为具有调节作用的配体,对炎症反应具有 抑制作用 。
合生元是益生菌和益生元的混合物。在大鼠实验中,合生元治疗 逆转了肠道微生物特定菌群丰度的变化 。
经过合生元(乳杆菌、双歧杆菌、链球菌和菊粉的组合)治疗的患有慢性肾病的大鼠中,肠道中产生吲哚的产气荚膜梭菌的 丰度降低至正常水平 。此外,合生元治疗可通过 改变肠道微生物 丰度来 有效调节 粪便中 吲哚及其衍生物的水平 。
合生元治疗由于其对 吲哚水平 的间接影响,可能成为许多神经系统和神经精神疾病的辅助治疗。最近一项针对 阿尔茨海默病 患者的临床实验表明,在使用合生元后, 神经炎症有所减轻 。
值得注意的是,合生元干预的 改善效果优于 单独的益生元或益生菌干预,这表明 复合干预 的组合更有可能成为临床治疗的实际应用。
粪菌移植
粪便微生物移植 (FMT)在先前的几项研究中已被证明对 缓解胃肠道微生物失调 具有不可否认的作用。通过FMT将 产生吲哚的益生菌 (乳酸杆菌、双歧杆菌等)移植到患者的肠道中,可以改善肠道微生物群。据观察,肠道中 产生吲哚的微生物群的丰度增加 , 吲哚及其衍生物的水平 受到间接影响。
吲哚是 色氨酸代谢 途径上的关键配体,可以调节和 抑制 神经和精神疾病的炎症。粪菌移植已被证明在各种疾病和临床治疗中对 改善 患者的肠道生态起着至关重要的作用,它可以通过 吲哚 在中枢神经系统疾病治疗中间接发挥作用,并被认为是一种 潜在的辅助疗法 。
调节饮食
肠道微生物 通过 色氨酸调节吲哚水平 。色氨酸是人体必需氨基酸之一,需要完全 依赖饮食摄入 。
以下是一些富含色氨酸的常见食物:
蛋白质食物: 肉类(牛肉、猪肉、鸡肉、火鸡)、鱼类(鳕鱼、鲑鱼、金枪鱼)、贝类(蛤蜊、扇贝)、蛋(鸡蛋、鸭蛋)、豆类(大豆、黑豆、红豆)、奶制品(牛奶、乳制品)等。
蔬菜和水果: 菠菜、花椰菜、蘑菇、芝麻、松子、香蕉、菠萝、樱桃、草莓、蓝莓等。
谷物和豆类: 燕麦、大麦、小麦、黑米、糙米等。
坚果和种子: 核桃、杏仁、腰果、葵花子、南瓜子、亚麻籽等。
研究表明,0.4%膳食色氨酸可 显著减少 衰老小鼠的 神经退行性病变 和 神经炎症 。在此过程中,补充色氨酸可以通过 改变肠道微生物组成 并 增加 阿克曼氏菌等有益细菌的丰度来 增强肠粘膜屏障功能 。肠道菌群产生的 吲哚类物质 (如吲哚乙酸、吲哚-3-丙酸) 显著升高 ,可以激活AHR,从而 抑制神经炎症 。
通过血清 靶向代谢组学分析 和 16s rRNA测序 对全身色氨酸代谢和肠道微生物组进行了分析,进一步证实了微生物群-肠-脑轴在 调节色氨酸饮食 产生吲哚的潜在作用。
虽然色氨酸饮食是一种可能的治疗策略,但过多的色氨酸摄入也被证明具有有害作用,应 注意适量摄入 。
此外,据报道, 间歇性禁食 还可能通过调节肠道微生物组成来 影响血浆吲哚 ,从而对神经和神经精神疾病的预后产生有益影响。 饮食调节 可能是 改善吲哚含量 的一种简单但有效的方法。
使用药物
最近的综合研究表明, 吲哚 通过作用于靶细胞来调节炎症反应和细胞生理。近年来,开发 吲哚类作用靶点 的药物一直是一个重要的研究热点。
吲哚及其衍生物充当 AHR的配体 ,并通过AHR间接 调节 星形胶质细胞和小胶质细胞的炎症。因此,直接作用于 AHR的激动剂 也可以作为内源性AHR配体(如吲哚)的替代品,并参与色氨酸AHR介导的 炎症抑制途径 。
体外合成的AHR配体2-(1′H-吲哚-3′-羰基)-噻唑-4-羧酸甲酯在一项临床研究中被证明具有 抑制自身免疫性脑脊髓炎进展 的能力。对AHR具有激动作用的药物有可能 取代色氨酸代谢产物 ,并作为外源性AHR配体激活自限制途径和修复神经和神经精神疾病。
除了靶向AHR, 影响吲哚作用途径 中其他靶点的药物也可能具有 治疗作用 ,这需要在未来进行更多的研究。
总结
由于 吲哚 是 肠道细菌 常见的代谢产物,其重要的生物学作用不容忽视。吲哚与 肠道菌群的稳态 和 肠道健康 直接相关,吲哚还可以间接影响 其他系统 和人体的 整体健康 。
吲哚对 人类健康 具有 有益影响 ,通过激活免疫细胞 释放抗炎因子 如IL-22来 调节肠道屏障 并帮助 维持肠道稳态 , 抑制 包括肠出血性大肠杆菌在内的病原菌的定植,以及 增加 MUC表达以 增强粘液屏障功能 。
此外,吲哚在 调节肠道微生态 方面也起着关键作用。它们 抑制有害菌株 ,并以影响基因表达的方式 改变肠道致病菌的毒力 ,这有助于 缓解 出血性结肠炎等疾病。同时,吲哚及其衍生物在激活AhR和PXR介导的 抗炎途径 中至关重要。例如 吲哚-3-丙酸 通过PXR介导肠细胞 TNF-α的下调 ,并上调编码生长抑素的mRNA,以 调节炎症 中的肠道通透性和肠道屏障功能。这意味着吲哚及其衍生物有前景的 治疗途径 。
尽管如此,吲哚也是一把 双刃剑 ,少数衍生物也存在一定的缺点。例如,吲哚肝脏代谢产生的 硫酸吲哚酚 在 高浓度 时具有 肾毒性 和 心血管毒性 ,可通过促进氧化应激、炎症等病理变化而导致 多系统功能障碍 。
吲哚 在 肠道稳态 和 人类健康 中发挥着至关重要的作用。许多 肠道细菌 被鉴定为将 色氨酸代谢为吲哚 。尽管如此,仍可能存在未鉴定的细菌,因此未来需要使用 代谢组学 和 宏基因组学 来进一步表征未知的 吲哚产生细菌 及其相关代谢途径。
不同浓度的吲哚 发挥着不同的生理功能。健康成年人的粪便吲哚浓度是已知的,而 人类肠道 和血液中许多 吲哚衍生物 的浓度仍然未知。缺乏在不同环境中测定 吲哚及其衍生物 浓度的定量方法,未来需要开发简单快速的测定方法。
未来仍需进一步研究 吲哚与人类健康 之间的关系。需要研究 多种吲哚组合 对 宿主生理学 的影响,并将这些发现与临床环境相结合,以开发 相关疾病的新疗法 。
主要参考文献
Zhou Y, Chen Y, He H, Peng M, Zeng M, Sun H. The role of the indoles in microbiota-gut-brain axis and potential therapeutic targets: A focus on human neurological and neuropsychiatric diseases. Neuropharmacology. 2023 Nov 15;239:109690.
Tennoune N, Andriamihaja M, Blachier F. Production of Indole and Indole-Related Compounds by the Intestinal Microbiota and Consequences for the Host: The Good, the Bad, and the Ugly. Microorganisms. 2022 Apr 28;10(5):930.
Ye X, Li H, Anjum K, Zhong X, Miao S, Zheng G, Liu W, Li L. Dual Role of Indoles Derived From Intestinal Microbiota on Human Health. Front Immunol. 2022 Jun 17;13:903526.
Lee JH, Lee J. Indole as an intercellular signal in microbial communities. FEMS Microbiol Rev. 2010 Jul;34(4):426-44.
Jiang H, Chen C, Gao J. Extensive Summary of the Important Roles of Indole Propionic Acid, a Gut Microbial Metabolite in Host Health and Disease. Nutrients. 2022 Dec 28;15(1):151.
Kumar A, Sperandio V. Indole Signaling at the Host-Microbiota-Pathogen Interface. mBio. 2019 Jun 4;10(3):e01031-19.
Chimerel C, Emery E, Summers DK, Keyser U, Gribble FM, Reimann F. Bacterial metabolite indole modulates incretin secretion from intestinal enteroendocrine L cells. Cell Rep. 2014 Nov 20;9(4):1202-8.
Lu Y, Yang W, Qi Z, Gao R, Tong J, Gao T, Zhang Y, Sun A, Zhang S, Ge J. Gut microbe-derived metabolite indole-3-carboxaldehyde alleviates atherosclerosis. Signal Transduct Target Ther. 2023 Oct 4;8(1):378.











