最近幾年,人們對腸道菌在癌癥治療中的作用越來越重視。特別是免疫治療中,已經有一些臨床試驗透過糞菌移植改善了免疫治療的效果。

但其實, 化療作為癌癥治療的基石手段之一,腸道菌群也深度參與到化療藥物的抗腫瘤作用過程,發揮著對化療療效不同的調節作用 。那麽在癌癥的化療中,腸道菌群都是如何影響到了化療的療效?
微生物群可以直接參與介導對化療藥物的治療反應
比如,腸道菌群協助增強化療藥物對癌細胞的雕亡作用。以氟尿嘧啶舉例,5-氟尿嘧啶 (5-FU) 是一種常用的化療藥,它是一種核苷類似物,在癌細胞復制自身DNA時可以混入其中,造成DNA復制錯誤,誘導癌細胞雕亡。
有研究發現, 嗜酸乳桿菌 和 幹酪乳桿菌 的混合物不會誘導結直腸癌細胞的雕亡,但與5-FU聯用時可以讓5-FU誘導癌細胞雕亡的能力增強40% [1]。
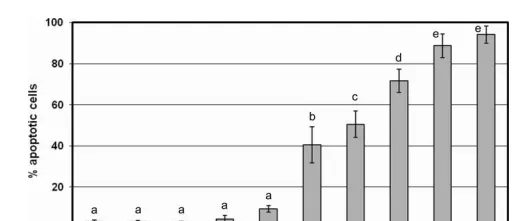
圖1.益生菌增強5-FU誘導癌細胞雕亡的能力
這其中的機制 可能與腸道菌群產生的後生元物質有關 。
後生元是益生菌經加工處理後的益生菌代謝物成分統稱,包括菌體與代謝產物。研究中還發現,使用輻照滅活 (對後生元影響較小) 的益生菌混合物也能產生同樣的增加療效的作用,而微波滅活 (會破壞後生元) 的益生菌混合物增強療效的作用較弱。
腸道菌群可以參與調節化療和放療中的治療後毒性
某些化療藥物的一些副作用非常嚴重,以至於它們會阻礙患者接受適當的劑量或治療持續時間。而這其中的一部份原因就是化療藥物本身會對腸道菌群產生幹擾 [2]。
以伊立替康為例,這是一種常用於治療結腸癌的化療藥物,它引入了一種活性化療藥物SN38,當它排泄到胃腸道時會 導致嚴重腹瀉 。這導致患者經常需要降低劑量或調整劑量,同時 雙歧桿菌 和 乳桿菌 物種的豐度也會降低,導致腸道菌群紊亂。
而化療引起的免疫力下降也使得部份患者需要使用抗生素預防感染,當抗生素的頻繁使用影響到健康腸道菌群時,治療的療效也會受到影響。
2015年,德國科隆大學分析了800名接受環磷醯胺治療的慢性淋巴細胞白血病患者的數據,其中45人使用過抗革蘭氏陽性菌的抗生素。相比其它患者,這45人的 ORR從90.2%降低到了74.3%,中位PFS從44.1個月縮短到14.1個月,中位OS從91.7個月縮短到56.1個月,療效出現明顯的下滑 [3]。
在另外122名接受鉑類化療的復發性淋巴瘤患者中,研究人員也發現了類似的現象。而予以相應的益生菌補充可能減少這種對療效的負性影響。
補充益生菌群這種對治療毒性的減緩作用也同樣在放療中被發現。一些研究已經證明了包括鼠李糖乳桿菌GG和VSL#3制劑 (由鏈球菌、乳酸桿菌和雙歧桿菌組成) 在內的益生菌如何保護腸道黏膜免受放射治療引起的毒性作用 [4]。
此外,對於接受放療和化療的頭頸部癌癥患者,聯合口服短乳桿菌 (Lactobacillus brevis) CD2含片可提高治療療效並降低治療誘發的黏膜炎的風險 [5]。
在化免聯合時代,益生菌群的補充可以進一步改善免疫治療的療效
化療藥都屬於細胞毒性藥物,可以直接對癌細胞產生殺傷,但是化療的療效並不全來自對癌細胞的直接殺傷,免疫系統也在其中有著重要的作用。化療藥除了殺傷癌細胞外,也會殺死骨髓源性抑制細胞 (MDSC) 、調節性T細胞 (Treg) 等免疫抑制細胞,重塑腫瘤微環境 [6]。被化療殺死的癌細胞也會暴露出更多的腫瘤抗原 [7],這些都能幫助免疫系統對抗腫瘤,這就是化免聯合治療的理論基礎。
而益生菌群在此時的加入 可以進一步促進抗腫瘤化免治療的作用 。 植物乳桿菌、鼠李糖乳桿菌、嗜酸乳桿菌 等許多不同的益生菌,都可以在減少化療毒性的同時,透過促進抗原呈遞、啟用NK細胞等途徑,增強免疫系統對腫瘤的殺傷能力 [8],對療效產生正面增效作用。
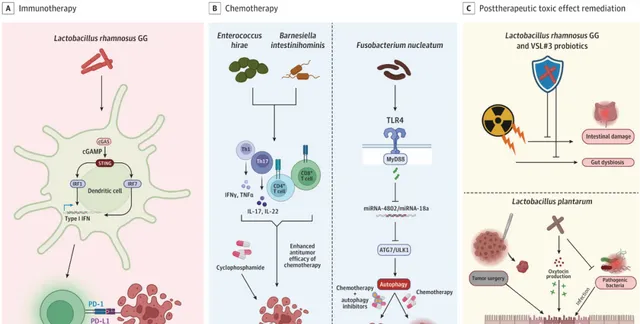
圖2.益生菌群深度參與抗腫瘤免疫治療、化療和治療後毒性中[9] 。
A.免疫治療:益生菌鼠李糖乳桿菌透過啟用cGAS/STING/TBK1/IFNregulatory-factor-7依賴性訊號通路觸發樹狀細胞產生I型幹擾素(IFN);這最終增強了程式性細胞死亡蛋白1(PD-1)免疫療法的抗腫瘤活性。
B.化療:海氏腸球菌(Enterococcus hirae)和Barnesiella intestinihominis可誘導Tp和Tp7的產生,並啟用腫瘤特異性CD4+和CD8+T細胞,這些細胞共同增強環磷醯胺的療效。此外,了解具核梭桿菌如何透過TLR4-MY88訊號通路啟用自噬從而導致化療耐藥,可用於透過將化療與自噬抑制劑聯合來增強治療反應。
C.治療後毒性:益生菌,如鼠李糖乳桿菌GG和VSL#3制劑(由鏈球菌、乳桿菌和雙歧桿菌組成)可保護腸道黏膜免受放療引起的毒性。此外,植物乳桿菌(Lactobacillus plantarum)可以透過促進調節腸-腦-皮膚軸的催產素分泌來促進腫瘤手術後的傷口愈合,還可以防止通常與手術部位感染有關的病原體在手術部位定植。
*cGAMP:環鳥苷酸-腺苷酸;cGAS:環鳥苷酸-腺苷酸合成酶;PD-L1:PD-1配體1;STING:幹擾素基因刺激因子。
益生菌群可以直接產生抗癌代謝物
益生菌的代謝物也是其影響癌癥治療的一大法寶。比如很多益生菌代謝都會產生的丁酸鹽,在免疫治療中就具有增強患者免疫力,改善免疫治療效果的作用。而除此以外,丁酸鹽在腫瘤的化療中也有特殊的作用。
有研究發現,將乳酸菌的培養液上清和丁酸鹽都能降低癌細胞的活力 [10]。他們與阿黴素聯合套用時能進一步增加癌細胞粒線體中活性氧 (ROS) 的產生,增強阿黴素對癌細胞的殺傷能力,甚至逆轉腫瘤對阿黴素的耐藥。
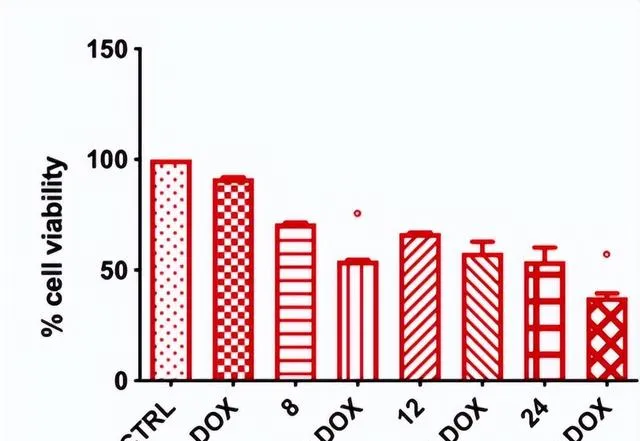
圖3.丁酸鹽逆轉阿黴素耐藥
綜上,腸道細菌在癌癥治療中的重要性無論怎樣強調都不為過,因為它具有開創癌癥治療新時代的潛力。有許多正在進行的臨床試驗開始將研究結果從實驗室轉化到臨床。咚咚嚴選專為放化療患者客製的樂愈達優護益生菌包含8種不同的復合益生菌菌株,其中 植物乳桿菌、嗜酸乳桿菌、鼠李糖乳桿菌 等都被發現有增強化療療效的作用。


相信在化療的路上,樂愈達優護益生菌會是您的「好幫手」。
參考文獻:
[1]. Baldwin∗ C, Millette∗ M, Oth D, et al. Probiotic Lactobacillus acidophilus and L. casei mix sensitize colorectal tumoral cells to 5-fluorouracil-induced apoptosis[J]. Nutrition and cancer, 2010, 62(3): 371-378.
[2]. Stringer A M, Gibson R J, Bowen J M, et al. Chemotherapy-induced modifications to gastrointestinal microflora: evidence and implications of change[J]. Current drug metabolism, 2009, 10(1): 79-83.
[3]. Pflug N, Kluth S, Vehreschild J J, et al. Efficacy of antineoplastic treatment is associated with the use of antibiotics that modulate intestinal microbiota[J]. Oncoimmunology, 2016, 5(6): e1150399.
[4]. Delia P, Sansotta G, Donato V, et al. Use of probiotics for prevention of radiation-induced diarrhea[J]. World journal of gastroenterology: WJG, 2007, 13(6): 912.
[5]. Sharma A, Rath G K, Chaudhary S P, et al. Lactobacillus brevis CD2 lozenges reduce radiation-and chemotherapy-induced mucositis in patients with head and neck cancer: a randomized double-blind placebo-controlled study[J]. European journal of cancer, 2012, 48(6): 875-881.
[6]. Zheng Y, Dou Y, Duan L, et al. Using chemo-drugs or irradiation to break immune tolerance and facilitate immunotherapy in solid cancer[J]. Cellular immunology, 2015, 294(1): 54-59.
[7]. Jackaman C, Majewski D, Fox S A, et al. Chemotherapy broadens the range of tumor antigens seen by cytotoxic CD8+ T cells in vivo[J]. Cancer Immunology, Immunotherapy, 2012, 61: 2343-2356.
[8]. Zitvogel L, Daillère R, Roberti M P, et al. Anticancer effects of the microbiome and its products[J]. Nature Reviews Microbiology, 2017, 15(8): 465-478.
[9]. Liu L, Shah K. The potential of the gut microbiome to reshape the cancer therapy paradigm: A review[J]. JAMA oncology, 2022, 8(7): 1059-1067.
[10]. Doublier S, Cirrincione S, Scardaci R, et al. Putative probiotics decrease cell viability and enhance chemotherapy effectiveness in human cancer cells: role of butyrate and secreted proteins[J]. Microbiological Research, 2022, 260: 127012.











