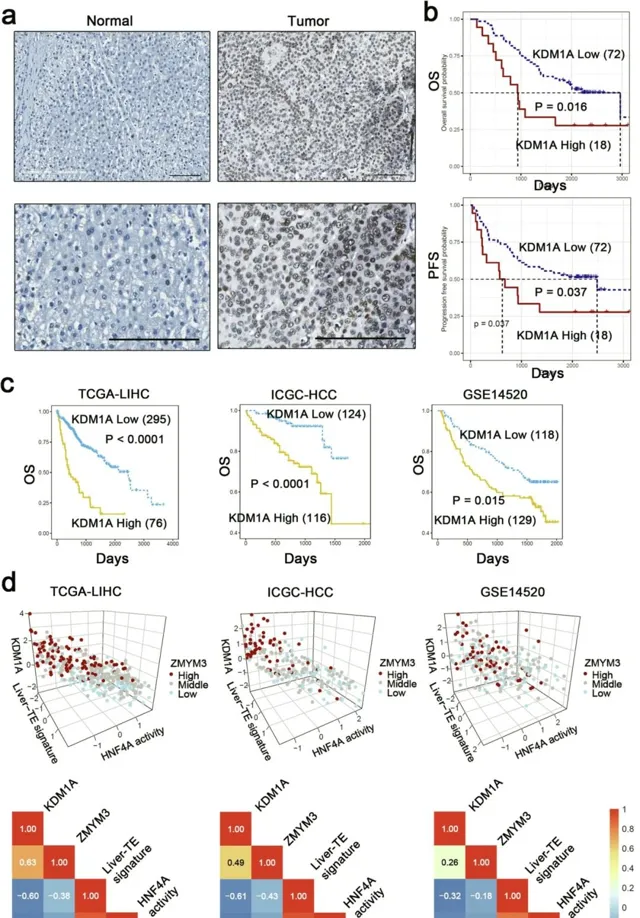
KDM1A在肝癌細胞中過度表達,預後不良。研究結論03在本研究中,團隊揭示了肝臟TE,在肝癌中的功能作用和重要性。團隊鑒定了富含組織蛋白標記、表觀遺傳調節因子的肝臟TE,並與一組與不良預後負相關的肝組織特異性基因相鄰。肝TE相關基因在肝組織和肝癌中,均高度表達。肝臟TE相關基因,包括已知的肝癌抑制基因,HNF4A34。具體來說,團隊重點研究了肝臟TE對HNF4A基因表現的調控作用。透過使用CRISPR/Cas9 技術,團隊選擇性地去除了位於肝癌細胞中HNF4A基因轉錄調控區(HNF4A-liver-TEs)內的肝臟TE。值得註意的是,這種肝臟-TE的缺失,導致HNF4A表達和腫瘤細胞生長抑制的顯著上調,為這種類別的DNA元件對HNF4A的抑制功能,提供了令人信服的證據。團隊的研究結果表明,組織蛋白標記物H3K4me1及其去甲基化酶KDM1A,在肝臟TE處富集,說明該區域染色質狀態的復雜調節。H3K4me1通常與強化子區域相關,其存在是活性強化子的標誌。然而,KDM1A是一種去甲基化酶,可去除組織蛋白中的H3K4me1標記,從而導致基因抑制。H3K4me1和KDM1A在肝臟TE上的共富集,似乎是矛盾的,但團隊為這一觀察結果,提出了幾種可能的解釋。一種可能的解釋是,KDM1調節肝臟TE位點的H3K4me1水平,以微調其轉錄調節活性。KDM1A 已被證明,可作為轉錄共抑制因子發揮作用,並可能與其他染色質調節因子協同作用,以沈默基因表現。在這種情況下,KDM1A在肝臟-TE中的存在,可以透過調節H3K4me1的水平,來幫助防止附近基因的異常啟用。另一種可能性是,肝臟-TE代表了活性和非活性強化子之間的過渡狀態,其中H3K4me1和KDM1A共存。在這種情況下,H3K4me1和KDM1A水平之間的平衡,可能決定TE衍生的CRE,是活躍的還是抑制的。低水平的KDM1A,可能允許H3K4me1在TE 衍生的CRE周圍持續存在,並維持活性狀態;而高水平的KDM1A,可能導致H3K4me1去除和隨後的沈默。總體而言,H3K4me1和KDM1A在肝臟TE上的共富集,表明該區域的反式啟用活性,具有復雜的調控作用。這與肝癌中KDM1A的高表達,和肝癌中肝TE相關基因的低表達一致。這為肝癌中KDM1A與肝臟TE相關基因表現之間的內在聯系,提供了機制上的見解。CRISPRa在HNF4A-liver-TE背景下的套用,也揭示了KDM1A的顯著調控作用。雖然CRISPRa技術通常用於誘導靶向基因表現,將會導致轉錄啟用;但團隊的研究結果,呈現出一種微妙的情況。團隊觀察到HNF4A-liver-TE的CRISPRa靶向,導致抑制染色質狀態。對這一觀察結果的合理解釋,是CRIPSRa誘導的TE的瞬時暴露,隨後募集KDM1A。因此,盡管CRISPRa預期啟用,但 KDM1A的募集導致,HNF4A 表達的抑制。這些結果突出了,基於CRISPRa的操作,與靶區環境之間錯綜復雜的相互作用。有必要進一步研究CRISPRa的這些非典型效應背後的確切機制,因為它們可能為開發更精細的基因操作策略,提供有價值的見解。團隊的研究結果,強調了KDM1A透過涉及HNF4A的兩種機制,在調節肝癌細胞生長中的關鍵作用。首先,KDM1A促進去甲基化,並限制肝臟TE的可及性,導致相關基因的抑制。團隊的研究表明,KDM1A透過與HNF4A TRR 內的肝臟TE結合,並抑制其表達,直接調節HNF4A。說明KDM1A參與抑制HNF4A 表達。其次,KDM1A與HNF4A復合物相互作用,在表觀遺傳學上沈默下遊基因,影響HNF4A的表達水平糊轉錄活性。HNF4A是肝臟TEs中富集的轉錄調節因子中的一個重要因子,其靶基因高度富集於肝臟TE相關基因中。這種相互作用和表觀遺傳調控,有助於KDM1A抑制肝臟TE相關基因。團隊的研究結果,揭示了KDM1A和HNF4A對肝癌生長的調控機制,突出了它們在肝臟TE可及性和轉錄活性中的重要作用。肝臟-TE/KDM1A/HNF4A調節環路,說明了這些因素在肝癌發展和進展中,錯綜復雜的相互作用。團隊的研究結果,表明了ZMYM3的功能意義,突出了其增強KDM1A的DNA結合特性,並將其調節功能引導至特定靶位點的能力。這種作用機制,與蛋白質復合物在調節基因表現中的更廣泛作用一致。其中復合物的特定組成,決定了其與特定DNA序列結合,並調節相關酶活性的能力。KDM1A的高表達,與肝細胞癌患者的不良預後有關,表明其作為預後生物標誌物的潛力。KDM1A和ZMYM3的表達水平,與肝TE相關基因和HNF4A下遊基因的表達譜呈負相關,強調了分子水平發現的臨床相關性。敲低KDM1A在體外和體內,均顯著抑制肝癌細胞生長,突出了KDM1A在HCC細胞生長中的重要作用。此外,使用靶向KDM1A的小分子抑制劑,可顯著抑制肝癌細胞的生長,表明KDM1A是HCC治療的有希望的靶點。使用KDM1A小分子抑制劑,可能是HCC治療的可行策略,需要進一步研究,以探索KDM1A作為HCC預後生物標誌物和治療靶點的臨床套用。總之,團隊的研究,提供了對肝臟TE在調節肝癌基因表現中的潛在作用的見解。此外,研究結果強調了KDM1A透過肝臟TE介導的機制,在肝癌細胞生長中的關鍵功能,特別是透過抑制HNF4A的轉錄活性。總體而言,本研究增強了對肝臟TE反式啟用活性精確調控的理解,從而為確定肝癌的新治療靶點開辟了途徑。











