VV-ECMO期間機械通氣的設定與監測
中山市小欖人民醫院 周卉芬
重癥行者轉譯組
引言
機械通氣可透過容積傷、氣壓傷、肺不張、肌損傷和生物損傷等多種機制,引起急性呼吸窘迫症候群(acute respiratory distress syndrome, ARDS)患者的呼吸機相關性肺損傷(ventilator-induced lung injury ,VILI)[1]。在最嚴重的ARDS中,雖然機械通氣的容量和壓力有限,但嬰兒肺越小,通氣風險的可能性越大。為了進一步限制機械通氣傳遞到肺部的能量,學者提出了更低的潮氣量(≤4 ml/kg)、呼吸頻率(<20次/min)和氣道壓(平台壓<25 cmpO和驅動壓≤15cmpO)的「超肺保護性」通氣策略[2]。但是,如不使用體外生命支持(ECLS)裝置進行體外瓦斯交換,這種策略可能導致嚴重的呼吸性酸中毒。靜脈-靜脈體外膜氧合(VV-ECMO)作為ECLS的一種形式,可替代自身肺功能、提供充分的體外血液氧合和二氧化碳去除。在隨機對照試驗(RCTs)和Meta分析中,VV-ECMO可顯著降低潮氣量、呼吸頻率、平台壓和驅動壓[3,4],且與生存獲益相關[3-6]。然而,ECMO時最佳機械通氣設定仍存在爭議。在這篇敘述性綜述中,我們總結了因嚴重ARDS接受VV-ECMO患者中進行機械通氣管理和監測的最新進展、原理和證據。我們還將討論這一領域的研究議程。
歷史背景
1 ECMO裏程碑試驗中的通氣策略
目前仍缺乏ECLS期間的最佳機械通氣設定的研究數據 (表1)。因此,目前的建議是基於專家意見[7]和極少數具有裏程碑意義的試驗結果的[3,4]。ECLS期間肺休息的概念首先由Gattinoni等人在一項非對照性系列中提出[8],即ARDS患者通氣時的吸氣峰壓限制在35-45 cmpO,低呼吸頻率(<5次/min),呼氣末正壓(PEEP)設定為15-25 cmpO。在CESAR試驗[4]中,患者被隨機分為兩組,一組在其原中心接受常規治療(90例患者),另一組則轉診到ECMO中心考慮接受ECMO治療(90例患者),後者在ECMO下采用「肺休息」策略(壓力控制模式,吸氣峰壓限制在20 -25 cmpO,PEEP 10 -15 cmpO,呼吸頻率10次/min,吸入氧濃度[FiO2] 0.3)。盡管ECMO組在6個月的死亡率或重度殘疾率更低,但該研究因多項方法學局限性而受到評論。具體來說,只有75%的轉診患者接受了ECMO治療,對照組中只有70%患者接受了保護性機械通氣。在EOLIA試驗[3]中,重度ARDS患者被隨機分配接受即刻VV-ECMO或常規保護性機械通氣。ECMO組采用輔助控制模式(降低潮氣量,使平台壓≤24cmpO, PEEP≥10 cmpO,呼吸頻率10 -30次/min,FiO2 0.3)或氣道壓力釋放通氣模式(APRV,高壓≤24 cmpO, PEEP≥10 cmpO,吸呼時間比1:2,FiO2 0.3)。在隨機分組後的數小時內,ECMO組患者潮氣量(6.0±1.3 vs. 3.5±1.0 ml/kg)、平台壓(30±6 vs. 24±3 cmpO)、驅動壓(18±7 vs. 13±2 cmpO)、呼吸頻率(30±5 vs. 23±2次/min)均顯著下降,而PEEP(12±4 vs. 11±3 cmpO)無變化。ECMO組死亡率較低(35% vs. 46%),但這一差異未達到統計學意義(p = 0.07)。
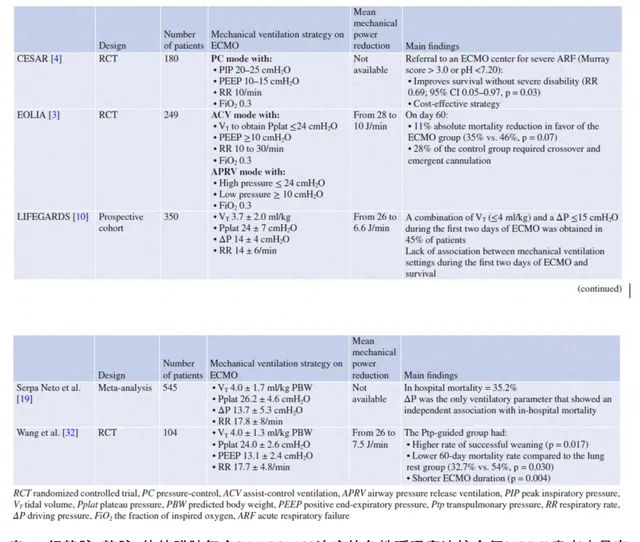
2有經驗的ECMO中心的當前實踐
2013年,283個體外生命支持組織(ELSO)註冊中心的141名醫學主任和ECMO計畫協調員進行了一項國際橫斷面調查[9],結果顯示,只有27%的中心對接受VV-ECMO的患者有明確的機械通氣方案。報告稱,這些中心中大多數(77%)將「肺休息」作為機械通氣的主要目標,而9%中心將「肺復張」作為通氣策略。76%的受訪者將潮氣量設定為≤6ml/kg,但只有34%的受訪者將潮氣量設定為< 4 ml/kg。77%的患者PEEP≤10 cmpO。急性呼吸窘迫症候群體外膜肺氧合患者的通氣管理(ventiLatIon management oF patients with Extracorporeal membrane oxyGenation for Acute Respiratory Distress Syndrome, LIFEGARDS)是最近第一項專門設計來描述接受ECMO治療的ARDS患者的通氣管理的前瞻性研究[10]。LIFEGARDS包括一個國際性、多中心佇列,其中包括10個國家的23個中至高容量ECMO重癥監護病房(icu)的350例接受ECMO支持的患者。它證實ECMO啟動後超肺保護通氣的廣泛套用,可顯著降低患者潮氣量(6.4±2.0 vs. 3.7±2.0ml/kg),平台壓(32±7 vs. 24±7 cmpO),驅動壓(20±7 vs. 14±4 cmpO),呼吸頻率(26±8 vs. 14±6次/min)和機械動能(26.1±12.7 vs. 6.6±4.8 J /min),而大多數病人PEEP(12±4 vs. 11±3 cmpO)均大於10 cmpO。然而,在ECMO前2天的呼吸機設定和生存率之間的多變量分析中未發現關聯。
3 ECMO期間目標性超肺保護性機械通氣
3.1潮氣量
降低潮氣量是限制機械通氣對肺部施加的應力和應變並因此導致VILI的基石。使用大鼠酸誘導肺損傷模型中,相同PEEP水平(10 cmpO)下,潮氣量從12 ml/kg降低至6 ml/kg、3 ml/kg,可減輕肺水腫和肺損傷、增加肺泡上皮細胞的保護作用[11]。實際上,由於體外二氧化碳清除(ECCO2R)裝置無法充分清除二氧化碳以控制呼吸性酸中毒,導致潮氣量下降程度受限(6.3-4.5 ml/kg),這可能解釋REST試驗未能改善ARDS患者結局的原因。相比之下,在被隨機分配至EOLIA試驗ECMO組的患者和LIFEGARDS佇列的患者中,ECMO可使其潮氣量下降振幅更大(<4 ml/kg)。體外生命支持組織(Extracorporeal Life Support Organization, ELSO)指南建議將目標潮氣量控制在4 ml/kg以下[7]。
3.2平台壓
平台壓易於在床旁測量,並在ARMA試驗[13]發表後受到了高度的關註。REVA Network關於pN1流感相關ARDS的研究報告稱[14],開始VV-ECMO治療後,存活者的平均平台壓顯著低於死亡者(25±3對29±5 cmpO;P < 0.01)。在該項研究中,VV-ECMO第一天較高的平台壓(>25 cmpO)與死亡率顯著相關(優勢比[OR] = 1.33, 95%可信區間[CI] 1.14 ~ 1.59, p < 0.01)。在最近的VV-ECMO系列[15,16]及ELSO[7]均推薦,將平台壓<25cmpO作為目標。
3.3驅動壓
驅動壓為平台壓減去PEEP。它也可以表示為潮氣量與呼吸系統順應性的比值(ΔP=VT/CRS),表明在ARDS患者中觀察到的肺功能尺寸的減小(即嬰兒肺)。在之前的隨機對照試驗和後續研究的事後分析中[10,17,18],驅動壓是ARDS患者死亡率的一個強有力的預測因子,驅動壓>14 cmpO與較高的死亡風險相關[17]。在一項對接受ECMO治療的成人ARDS患者的觀察性研究中,個體患者數據薈萃分析報告顯示,驅動壓是唯一與院內死亡率獨立相關的通氣參數[19]。在這種情況下,將VV-ECMO的驅動壓設定為<14 cmpO似乎是可取的,目前該目標套用於ECMO裝機容量較高的醫療中心[10]。
3.4呼吸頻率
肺萎陷和擴張的頻率,即呼吸頻率會導致VILI。在豬ARDS模型中,Grasso等評估了呼吸頻率降低聯合ECCO2R的獲益[20]。在固定潮氣量(6 ml/kg)時,較低的呼吸頻率與減少生物創傷相關且保留肺通氣 [20]。對LUNG SAFE研究[21]進行的二次分析也證實,較高的呼吸頻率與院內死亡率增加獨立相關。最近,Costa等[22]在包含4,549例ARDS患者的回顧性匯總資料庫中證明,只有驅動壓和呼吸頻率與死亡率顯著相關。在這項研究中,驅動壓對死亡率的影響是呼吸頻率的4倍。ELSO推薦的呼吸頻率為4 ~ 15次/min[7],而EOLIA和LIFEGARDS研究報告的ECMO治療時的呼吸頻率更高,分別為(23±2)[3]和(14±6)[10]。然而,在超肺保護性通氣期間,可能需要保持最低呼吸頻率(4次/min)來維持肺容量和避免通氣不足[8]。
3.5機械能
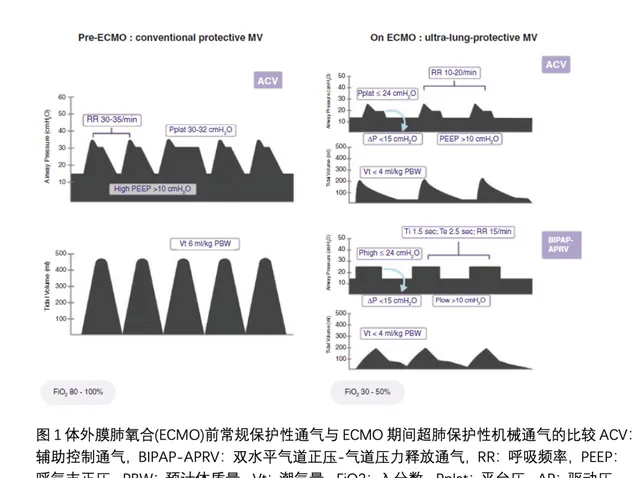
機械能代表由呼吸機傳遞給呼吸系統的能量[23]。它是跨肺壓、潮氣量和呼吸頻率的函式,並被證明與ARDS患者在>為17 J/min時的死亡率獨立相關[24]。在ECMO過程中套用超肺保護性通氣可顯著降低機械能。事實上,與EOLIA試驗中的對照組相比,ECMO組的機械能顯著下降(10 J/min vs. 28 J/min),這一效應是由潮氣量和呼吸頻率分別降低43%和23%介導的[25]。同樣,在LIFEGARDS佇列研究[10]中,ECMO啟動後的平均機械能從26 J/min降低至6.6 J/min。雖然機械能的概念有一定的局限性,但它可以量化所有可調節的機械通氣參數(潮氣量、呼吸頻率、驅動壓、PEEP、吸呼比、吸氣流量)對VILI的影響。雖然其計算方法可能有助於指導目前的臨床實踐(圖1),但仍不確定應在多大程度降低ECMO患者的機械能。
3.6套用呼吸暫停通氣?
最近一項在10例接受VV-ECMO治療的ARDS患者中進行的隨機交叉生理學研究提出[18],將潮氣量降至4 ml/kg以下可能不足以防止機械通氣對炎癥和不均一肺帶來的過度應變(定義為潮氣量/呼氣末肺容積)。在這項研究中,盡管呼吸系統順應性低的患者的平均潮氣量為2.4 ml/kg,但其生物創傷和VILI的顯著風險仍然存在。在機械通氣過程中,吸氣壓力的變化與血漿可溶性晚期糖基化終末產物受體(S-RAGE)、白血球介素(IL) -6、腫瘤壞死因子(TNF) - α濃度之間存線上性關系。在持續氣道正壓通氣(CPAP)模式(10 cmpO)中,不進行潮氣量通氣時生物創傷最低。同樣,Graf等在一項前瞻性、單中心生理學研究[26]中比較了24例接受VV-ECMO的重度ARDS患者的肺保護性通氣和呼吸暫停通氣。盡管驅動壓較低(11.9±5.8 cmpO),但超肺保護性通氣與應力、應變和機械能增加相關。在VV-ECMO支持的ARDS大動物模型中[27],與常規通氣策略相比,近呼吸暫停通氣(驅動壓10cmpO, PEEP 10cmpO,呼吸頻率5次/min)也與肺損傷和纖維增殖減少相關。雖然(近)呼吸暫停通氣可能是降低ECMO期間VILI的最終策略,但目前廣泛套用還需要更多的數據和更大規模的以患者為中心的研究。還應評估近呼吸暫停通氣的局限性。無肺迴圈可能產生短期和長期的生理後果,可能需要更深的鎮靜,有時需要連續的神經肌肉阻滯來控制呼吸驅動,以及隨後的患者自身造成的肺損傷(P-SILI)。該操作還需要更高的VV-ECMO回路血流量以達到充分的氧合,可能引起溶血等並行癥。
3.7保留自主通氣和膈肌功能以減少P-SILI?
透過允許自主呼吸運動來保留膈肌功能可能有助於機械通氣的撤機,因為機械通氣時,膈肌短時間(18-69小時)不運動與跨膈壓降低55%以及慢肌和快肌膈纖維顯著萎縮相關[28]。另一方面,在高呼吸驅動和低肺順應性的患者中,自主呼吸可能與強烈的呼吸努力和跨肺壓升高相關,導致P-SILI[29,30]。雖然從控制通氣轉換為輔助自主通氣有多項益處(保留肌肉功能、降低鎮靜深度、改善血流動力學),但對於接受ECMO的最嚴重型別ARDS患者,在維持(部份)膈肌活動的同時盡量減少P-SILI具有挑戰性。在這種情況下,結合控制平台壓和驅動壓,同時允許非同步自主呼吸的APRV模式可能是有益的。
4ECMO時如何設定最佳PEEP
與任何幹預措施一樣,超肺保護性通氣策略並非毫無風險。事實上,由此導致的平均氣道壓下降可能導致肺復張不足、肺不張和生物創傷。嚴重損傷的肺也可同時發生肺萎陷和過度擴張。有趣的是,在對ECMO專科醫師進行的一項國際調查中,77%患者的PEEP≤10 cmpO,而ELSO指南建議在ECMO支持期間采用中等水平的PEEP (10 cmpO) [7]。然而,ARDS患者的最佳PEEP因患者而異,並取決於幾個因素(肺泡可復張性、胸膜壓力、體重和血流動力學),並且也可能在病程中迅速演變。因此,為特定患者和特定時間點選擇合適的PEEP具有挑戰性,「一刀切」的策略可能沒有任何臨床益處。最近,有幾種方法來指導臨床醫師在ECMO超保護性通氣期間實作PEEP的個體化水平(圖2)。

4.1電阻抗斷層成像指導策略
電阻抗斷層成像(Electrical impedance tomography, EIT)可在床旁對肺部進行個體化、無創、無放射線成像,並進行全域和局部的動態肺分析。該技術用圖形表示肺通氣的區域分布,並提供通氣的即時資訊,包括通氣分布的異質性、區域潮氣量和呼吸系統順應性的重力分布。它能辨識肺內阻抗的變化,並能區分通氣和非通氣的肺泡單位。因此,EIT可以指導PEEP滴定和最佳設定,最大限度地減少肺萎陷和過度擴張。Franchineau等表明,在由15例ECMO患者組成的研究中,由EIT衍生的「最佳折中」PEEP存在廣泛差異,有7例、6例和2例患者的值分別為15 cmpO、10 cmpO和5 cmpO,但從未選擇PEEP 20 cmpO和PEEP 0 cmpO [31]。透過EIT評估各側肺內關閉的氣道和開放的氣道分布情況,以及兩肺之間的通氣情況(生物創傷AiCLOSE研究,Biotrauma AiCLOSE Study,ClinicalTrials.gov Identifier: NCT05196074)。
EIT有其局限性。首先,該技術僅提供特定肺區域的橫斷面評估(可能與全肺不同),且僅捕獲腹側-背側區域通氣分布。第二,它需要特定的裝置,目前還沒有得到廣泛套用,且數據的獲取費時。最後,關於確定最佳PEEP水平的EIT目標參數仍缺乏共識。這種以EIT為指導的通氣策略對進一步降低ECMO期間VILI的獲益值得進一步研究。
4.2跨肺壓指導策略
平台壓是對肺施加壓力的壓力梯度的替代指標,即跨肺壓。由於胸膜壓與食管壓相關,因此食管測壓儀可用於計算呼氣末跨肺壓。這種以壓力為導向的最佳化PEEP策略可以限制肺不張,並將肺過度擴張的風險降至最低。它已被用於確定適合ECMO的患者(即盡管有最佳PEEP,但仍存在難治性低氧血癥)[20]或最佳化ECMO的PEEP[32]。在後項研究中,接受VV-ECMO治療的患者被隨機分配接受跨肺壓指導通氣(n = 52)或肺休息策略(n = 52)[32]。與肺休息組相比,跨肺壓指導組的撤機成功率較高,60天死亡率顯著較低(33% vs. 54%, p = 0.03), ECMO上機時間較短(p = 0.004)。然而,在ARDS患者中,跨肺壓指導策略仍存在爭議,且在EPVent-2試驗結果中不支持[33]。
4.3其他方法
肺臟超聲可用於指導ARDS患者機械通氣的設定,床旁評估肺復張情況[34]。在一系列接受常規機械通氣的ARDS患者中,肺部超聲評分的變化與PEEP誘導的呼氣末肺容積增加相關,並且在接受ECMO治療的18例患者中,也與電腦斷層掃描(CT)數據顯著相關。
肺復張與肺膨脹(R/I)比值是最近開發的一種評估肺復張潛力的工具。它的計算方法是套用高PEEP後復張肺的順應性與在較低PEEP下測量的呼吸系統的順應性的比值。該參數可以在ICU床旁使用任何呼吸機輕易測量,並可能有助於最佳化呼吸機設定,特別是PEEP[37]。到目前為止,還沒有這一參數在極低潮氣量的ECMO中的研究。
5 ECMO期間的俯臥位
俯臥位是中重度ARDS患者的有效的一線幹預措施[38],且應在考慮使用ECMO之前強制實施。然而,盡管ECMO期間俯臥位通氣的套用越來越多,尤其是在2019冠狀病毒病(COVID-19)大流行期間,這一操作仍存在爭議。幾項觀察性研究和最近的一項薈萃分析表明,在ECMO期間俯臥位是可行的、安全的,且可加快ECMO撤機並改善結局[39,40]。迄今為止,缺乏隨機對照試驗、擔心意外脫管以及護理人員培訓困難仍然是該操作在ECMO患者中推廣使用的障礙,尤其是在ECMO容量較低的中心。正在進行中的PRONECMO隨機對照試驗(ClinicalTrials.gov Identifier: NCT04607551)的結果可能有助於闡明ECMO患者俯臥位的適應證。
6 ECMO瓦斯交換目標
關於接受ECMO支持的ARDS患者的氧合、二氧化碳或pH的管理,目前尚無循證指南。盡管低氧血癥和高氧血癥均與死亡率增加相關[41],低氧血癥和高碳酸血癥的安全範圍尚未確定。在獲得更多數據前,EOLIA試驗中實施的瓦斯交換目標(PaO2 65-90 mmHg;PaCO2 < 45 mmHg)[3]最常被推薦。由於目前的ECMO膜可顯著降低機械通氣強度,並在殘余肺功能極低的情況下確保充分的瓦斯交換,因此呼吸機FiO2應降低至最低值。此外,在低通氣-灌註比的肺區域,高濃度的FiO2可能導致脫氮性肺不張,尤其是當低PEEP時[42]。最後,ECMO啟動後應避免高碳酸血癥的快速糾正,因其與神經系統並行癥的發生相關[43]。
7 ECMO撤機過程中的機械通氣
目前,ECMO撤機過程中機械通氣的關註較少。在EOLIA試驗中,當「臨床、放射學、瓦斯測量和肺順應性改善」時,患者轉為容量輔助控制通氣,潮氣量設定為6 ml/kg[3]。最近,在一項含83例ECMO撤機患者的系列中,在掃氣試驗期間潮氣量、心率、通氣比和食管壓力波動較大的患者安全脫離VV-ECMO的可能性較低[44]。如前所述,ECMO期間的俯臥位也可能有助於離線。
8結論
ARDS患者ECMO治療期間的機械通氣應以降低VILI程度為目標。然而,在ECMO治療過程和撤機階段應如何調整特定的呼吸機變量仍需要進一步的研究來確定。在此之前,EOLIA呼吸機設定[3]不失為一個合理的選擇。
參考文獻:略











